
基礎生物学研究所




2017.12.08
基礎生物学研究所 統合神経生物学研究部門では、これまでタンパク質チロシンホスファターゼである PTPRZ が脱髄疾患である多発性硬化症や悪性の脳腫瘍であるクリオーマに対する創薬ターゲットになることを明らかにしてきました。PTPRZは細胞膜上に存在する受容体であり、その細胞外領域がコンドロイチン硫酸(CS)鎖によって修飾されています。PTPRZを含め、CS糖鎖で高度に修飾された糖タンパク質は、コンドロイチン硫酸プロテオグリカン(CSPG)と総称されています。慢性化した多発性硬化症の脱髄巣ではCSPGが蓄積しており、オリゴデンドロサイトが髄鞘を再生するのを妨げていると考えられています。
今回、同研究部門の久保山 和哉 研究員、藤川 顕寛 研究員、野田 昌晴 教授らは、脱髄の病巣部を模倣したオリゴデンドロサイト前駆細胞の分化アッセイ系を構築し、これを用いて髄鞘再生を抑制するCSPGの働きを中和する物質を探索しました。その結果、CSPGによる髄鞘を形成するオリゴデンドロサイト分化抑制作用が、塩基性ペプチドであるプロタミンによって効果的に中和されることを見出しました。またマウスにおいて、クプリゾン投与によって実験的に誘導された脱髄病態からの回復が、脳室内にプロタミンを投与することで早まることを明らかにしました(図1参照)。
本成果は米国時間 2017 年 12 月 7 日にオンライン科学雑誌PLOS ONE に掲載されます。
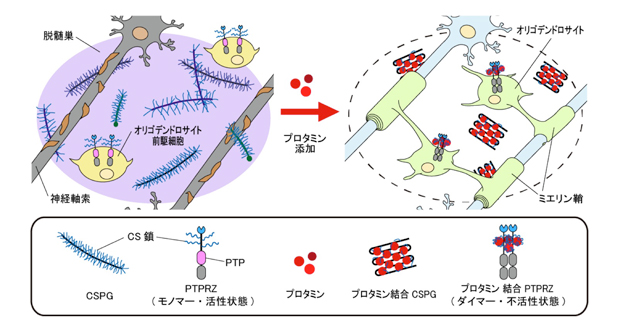
図1: プロタミンによるCSPGの中和効果(モデル図)
オリゴデンドロサイト前駆細胞の脱髄部位への移動やオリデンドロサイトへの分化は脱髄巣に集積しているCSPGによって抑制されている。オリゴデンドロサイト前駆細胞に発現しているPTPRZもCSPGであり、オリゴデンドロサイ前駆細胞を未分化状態に維持するよう働いている。このようなCSPGの抑制効果はプロタミンによって中和されると考えられる。
【背景】
髄鞘(ミエリン鞘)は、オリゴデンドロサイト(希突起膠細胞)というグリア細胞の細胞膜が神経軸索に巻き付いて形成されています。髄鞘は、絶縁シートのような役割を担っており、これが損傷すると神経の情報伝達能や生存自体が損なわれて、四肢の麻痺や失明などにつながります。
代表的な脱髄疾患である多発性硬化症では、慢性化に伴い髄鞘の再生回復能が徐々に損なわれてしまうことが大きな問題です。その原因として、脱髄巣へのコンドロイチン硫酸プロテオグリカン(CSPG)の集積があります。CSPGは、オリゴデンドロサイト前駆細胞の脱髄部位への移動を妨げるバリアとなることや、オリゴデンドロサイト前駆細胞が髄鞘を形成するオリゴデンドロサイトへと分化成熟することを阻害してしまうことが知られています。
髄鞘再生に対する抑制効果は、CSPGのコンドロイチン硫酸(CS)糖鎖に由来することがわかっています。動物実験では、CS鎖の酵素分解による除去や、CS鎖の生合成を阻害する化合物によって、髄鞘の再生が促進することが示されています (Lau LW et al., Nat Rev Neurosci 14, 7222-729, 2013; Keough MB et al., Nat Commun 7, 11312, 2016)。
脱髄巣においてCS鎖の働きを抑えることができれば、髄鞘修復は再び可能になると期待されます。そこで我々は、脱髄巣を模倣した細胞アッセイ系を構築し、CSPGによるオリゴデンドロサイトに対する抑制作用を中和する物質を探索しました。
【研究成果】
バイオアッセイ(生物学的評価法)は、創薬の初期評価法として最も重要視されるステップです。髄鞘を形成するオリゴデンドロサイトについては、細胞の分化特性を良好に保持した細胞株は市販されていないため、実験ごとにマウスやラットの新生仔脳から未分化グリア細胞を分離する必要がありました。我々は、以前の研究において、p53遺伝子ノックアウトマウスからオリゴデンドロサイトへの分化能を保持したオリゴデンドロサイト系譜細胞(OL1細胞)を樹立していました(2015年プレスリリース参照)。今回、これをアッセイ用細胞としました。
脱髄巣からCSPGを単離することは現実的ではないため、脱髄巣に含まれる代表的なCSPGとして、市販品として入手できるアグリカンを用いて培養皿をコートすることで、脱髄巣におけるCSPGが集積した環境を再現しました。その結果、50 µg/ml以上のアグリカンでコートした培養皿上では、甲状腺ホルモン刺激によるOL1細胞のオリゴデンドロサイトへの分化が抑制されることが確認されました(図2)。
本バイオアッセイ系に様々な化合物やペプチドを添加して調べたところ、ヘパリン拮抗剤として用いられてきた塩基性ペプチドであるプロタミンが、アグリカンによる分化抑制を最もよく中和(キャンセル)することが判明しました(図3A)。これまでにオリゴデンドロサイトへの分化を促進することが明らかにされていた、ペプチドのプレイオトロフィン(図3B)や低分子化合物のミコナゾール(図3C)による分化促進活性は、アグリカン存在下では大きく損なわれることが判りました。
一方、プロタミンは、アグリカンをコートしない条件下でも細胞分化を促進しました(図3D)。このことは、プロタミンが、アグリカンの中和作用以外にも細胞分化を促進する能力があることを示唆しています。プロタミンがアグリカン非存在下でも細胞分化を促進したのは、オリゴデンドロサイト前駆細胞に発現するCSPG分子であるPTPRZに対するリガンド効果であることが判りました。PTPRZは細胞膜を貫通する膜タンパク分子であり、細胞内側にタンパク質チロシンホスファターゼ(PTP)という脱リン酸化酵素の活性ドメインを有しています。PTPRZの細胞外領域にはコンドロイチン硫酸(CS)鎖が多数結合しており、CSPGとしての機能も有するユニークな分子です。我々はすでに、PTPRZがオリゴデンドロサイトを未分化状態に留めるブレーキとして働くことを明らかにしていました(2012年プレスリリース参照)。
最近、PTPRZのCS鎖は、本受容体を単量体に保ち、そのホスファターゼ活性を維持するために必要であることが判明しました(2016年プレスリリース参照)。神経細胞は、髄鞘損傷などでダメージを受けると、分泌性ペプチドであるプレイオトロフィンを周囲に分泌します。このプレイオトロフィンは、オリゴデンドロサイト前駆細胞に発現しているPTPRZのCS鎖に対して高親和性で結合し、その結果、PTPRZの2量体化が促進します。2量体化によってPTPが不活化することで、髄鞘を形成するオリゴデンドロサイトへの分化が始まり、髄鞘を修復しているものと考えられます(2015年プレスリリース参照)。
以上の結果を総合すると、プロタミンは、PTPRZを含む全てのCSPG分子に対して中和作用を有していると考えられます。
アミノ酸のアルギニン残基を多く含むプロタミンは、これまで細胞膜透過性ペプチド(cell penetrating peptide:CPP)やドラッグデリバリーシステム(Drug Delivery System, DDS)の用途でも用いられており、プロタミンが結合したタンパク質を鼻腔内投与すると脳内に運ばれることが報告されていました(Lin T et al., Acta Pharm Sin B. 6326, 352-358, 2016)。生後5日から新生仔マウスに対して、プロタミンを鼻腔内に毎日投与し、髄鞘形成が始まる生後10日における髄鞘のマーカータンパク質である、ミエリン塩基性タンパク質(MBP)の発現レベルや組織発現分布を評価したところ、プロタミン投与によって髄鞘形成が有意に早まっていることが判りました(図4)。
また、成体のマウスの脱髄モデル(クプリゾン投与脱髄モデル)に対しても、脳室内にプロタミンを直接投与したところ、髄鞘の回復が有意に促進されることが判明しました(図5)。
【本研究の意義】
プロタミンがCSPGを中和することは大きな発見です。プロタミンはヘパリン拮抗剤として医療で用いられていますが、今後、CSPGに対する選択性を高めるなどの改良が必要と考えられます。また本研究において構築した脱髄巣の環境を再現した細胞アッセイ系は、髄鞘再生を促進する化合物や抗体などを引き続き開発する上で非常に有用なツールになることが期待されます。
本研究の成果は、培養細胞や実験動物などを用いた基礎研究であり、ヒトへの治療効果を示すものではありません。
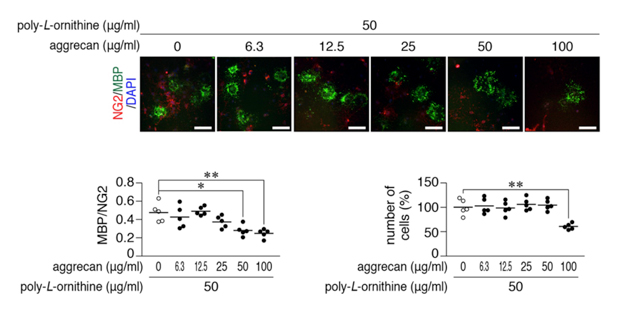
図2: アグリカンによるOL1細胞の分化抑制
マウスオリゴデンドロサイト系譜OL1細胞を様々な濃度のアグリカン(0〜100 µg/ml)でコートした培養皿上に播種し、甲状腺ホルモンにより細胞分化を誘導した(培養皿への細胞接着を高めるため一定量のオルニチンで同時にコートしている)。オリゴデンドロサイト前駆細胞のマーカーであるNG2(ニューログリカン2、赤色)と成熟したオリゴデンドロサイトのマーカーMBP(ミエリン塩基性タンパク質、緑色)で細胞を染色し、NG2陽性細胞数に対するMBP陽性細胞数の増加によって細胞分化の程度を評価した。スケールバー:100 µm。
アグリカンの濃度依存的にMBP 陽性細胞(オリゴデンドロサイト)の出現が減少し、50 µg/ml以上の濃度で有意であった(左下グラフ)。* P < 0.05, ** P < 0.01。
100 µg/mlのアグリカンでコートすると、培養皿へのOL1細胞の接着性も阻害されるため、以後のアッセイでは50 µg/mlで実施した。** P < 0.01。
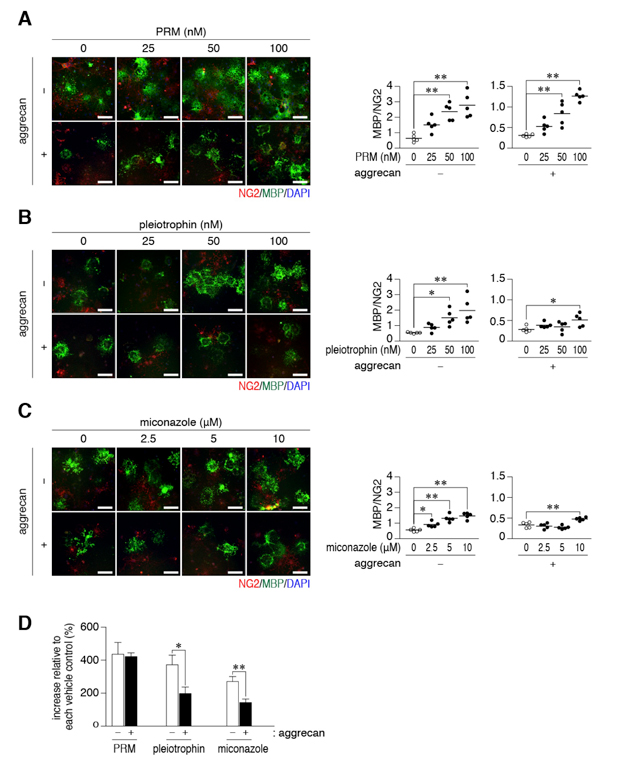
図3: プロタミンによるOL1 細胞の分化促進
A-C, OL1細胞をオルニチンのみ(−)、オルニチン+アグリカン(+)でコートした培養皿上に播種し、甲状腺ホルモン存在下、プロタミン(A)、プレイオトロフィン(B)、ミコナゾール(C)を添加し、細胞分化を誘導した。スケールバー: 100 µm。OL1細胞の分化は図2と同様に評価し、それぞれの顕微鏡写真の右にグラフで表記した。* P < 0.05, ** P < 0.01。
D, 最大用量における細胞分化の促進効果(溶媒コントロールに対する)を比較すると、プロタミンは、アグリカンの有無に関わらずOL1細胞の分化をよく誘導するのに対して、プレイオトロフィンとミコナゾールの促進効果は、アグリカンコートにより損なわれる。* P < 0.05, ** P < 0.01。
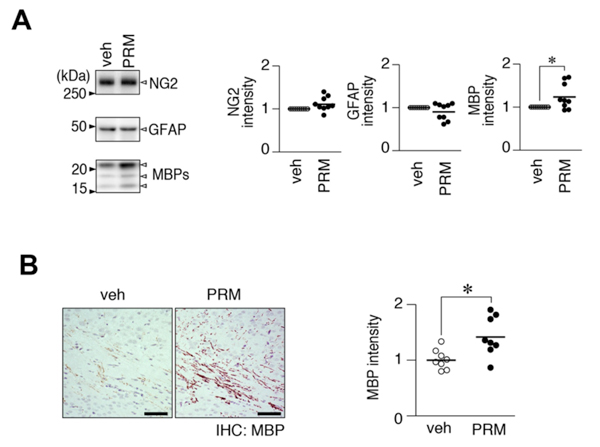
図4: 仔マウスへのプロタミンの鼻腔内投与
A, プロタミン(PRM)及び溶媒(veh)の鼻腔投与後のマウス脳内におけるグリア細胞のマーカータンパク質のウエスタン解析。オリゴデンドロサイト前駆細胞のマーカー(NG2)とアストロサイト(GFAP)に差異はないが、成熟オリゴデンドロサイトのマーカー(MBP)は増加した。* P < 0.05。
B, MBPの免疫組織染色像。スケールバー: 50 µm。プロタミン(PRM)投与群では、MBP陽性(茶色)のシグナルが脳梁部で増強している。* P < 0.05。
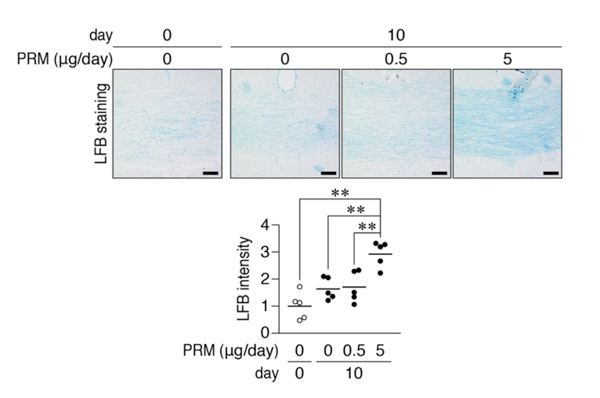
図5: クプリゾン投与脱髄モデルへのプロタミン脳室内投与
成熟マウスを2%クプリゾン含有餌で飼育すると、6週間後に脳梁部にほぼ完全な脱髄状態が誘導される(左端図参照)。その後、通常餌飼育に戻すと同時に、マウスに浸透圧ポンプを装着し、プロタミン(PRM)を脳室内に連続微量注入した。10日間の投与後、脳切片を作成、LFBによる組織染色によって髄鞘(青色に染色される)の回復を評価した。スケールバー: 50 µm。1日あたり5 µgのプロタミンの投与量において髄鞘回復が有意に亢進することが判明した。**P < 0.01。
【発表雑誌】
英国オンライン科学誌 PLOS ONE 米国時間2017年12月7日掲載
論文タイトル:Protamine neutralizes chondroitin sulfate proteoglycan-mediated inhibition of oligodendrocyte differentiation
著者:Kazuya Kuboyama, Naomi Tanga, Ryoko Suzuki, Akihiro Fujikawa, and Masaharu Noda
DOI: https://doi.org/10.1371/journal.pone.0189164
【研究サポート】
本研究は、科学研究費補助金若手研究 B(研究課題26830050,代表研究者:久保山 和哉)、基盤研究C(17K0735,代表研究者:久保山 和哉)、基盤研究C(21700416, 藤川 顕寛)、基盤研究C(24500390, 藤川 顕寛)、文部部科学省の科学研究費補助金・新学術領域研究「統合的神経機能の制御を標的とした糖鎖の作動原理解明」の公募研究(26110722, 藤川 顕寛)および、基盤研究A(16209008, 野田 昌晴)による支援を受けて行われました。
【本件に関するお問い合わせ先】
基礎生物学研究所 統合神経生物学研究部門
研究員: 藤川 顕寛 (フジカワ アキヒロ)
TEL: 0564-55-7593 (研究室)
E-mail: fujikawa@nibb.ac.jp
基礎生物学研究所 統合神経生物学研究部門
教授: 野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846 (研究室)
E-mail: madon@nibb.ac.jp
URL: http://niwww3.nibb.ac.jp/
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp