
基礎生物学研究所




2015.09.03
基礎生物学研究所 統合神経生物学研究部門の野田昌晴 教授の研究グループは,脳神経回路の髄鞘損傷からの再生を促す仕組みを発見しました。
神経細胞から伸びる軸索は,髄鞘(ミエリン鞘)と呼ばれる絶縁シートに覆われることで,高い信号伝達能を獲得しています。通常,この髄鞘は破損しても修復されますが,その回復を制御する仕組みはよくわかっていませんでした。今回,髄鞘を形成するオリゴデンドロサイト(希突起膠細胞)という細胞を選択的に傷害するクプリゾンという物質をマウスに与えた後に,その回復過程を調べたところ,脱髄によって傷ついた神経軸索からはpleiotrophinというタンパク質が分泌されており,これが髄鞘になるオリゴデンドロサイトの前駆細胞上に存在するPTPRZという受容体分子の機能を抑制することで,細胞の分化を促し,髄鞘の回復に寄与していることがわかりました。
多発性硬化症などの脱髄疾患では,髄鞘の絶縁シートが壊れてしまうことで,視力低下や手足のしびれ,運動障害などの症状が生じます。今回の成果は,PTPRZの働きを抑制することで,髄鞘の回復を促すことができることを示しており,新しい治療法開発の可能性を示しています。
本研究の成果は,米国東部時間2015年9月2日に米国神経科学会誌The Journal of Neuroscienceに掲載されます。
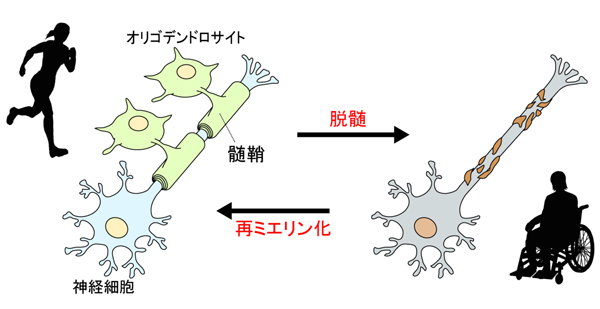
図1: 脱髄と再ミエリン化
脳神経系の有髄神経の軸索は,オリゴデンドロサイトの細胞膜で覆われている。この覆われた部分は髄鞘と呼ばれ,絶縁シートとして働く。健常人では,髄鞘が傷ついても修復(再ミエリン化)されるが,脱髄疾患では,この髄鞘がひどく損傷した状態になっており,運動障害などが引き起こされる。
【背景】
髄鞘(ミエリン鞘)は,オリゴデンドロサイト(希突起膠細胞)という細胞がその細胞膜を神経軸索に巻き付けて形成されています。この髄鞘が絶縁シートのように働くことで,跳躍伝導と呼ばれる非常に速い神経伝達が可能になります。脱髄疾患では,この髄鞘の構造と機能が大きく失われることで,四肢の麻痺や失明などの症状が引き起こされます。最も有名な脱髄疾患である多発性硬化症は,女性の罹患率が高く,その平均発症年齢30歳前後です。出産・育児に多大な困難を及ぼすため,精神的にも社会的にも大きな損失です。多発性硬化症は厚生労働省の指定難病の一つであり,その治療法の確立が待ち望まれています。
脱髄疾患に対する既存治療の主体は,炎症や自己抗体による攻撃を阻んで,髄鞘の破壊が進行しないように食い止めることです。しかし,脱髄の生じた部位が修復されなければ,症状の改善は見込めません。そこで,その修復を効果的に促すような,再ミエリン化誘導薬の開発が注目されています(図1)。
【研究成果】
研究グループは,髄鞘を選択的に破壊する薬剤であるクプリゾンを含む食餌を与えることで,マウス脳内に人為的に脱髄を誘発した後,そこから回復する過程を解析しました。その結果,脱髄状態のマウス脳内では,正常な脳組織ではほとんど作られていないpleiotrophinと呼ばれる分子が発現していることが判りました。この発現は一過性であり,脱髄からの回復が進むと低下していくことから,pleiotrophinの発現が髄鞘の回復に関与していると予想されました(図2A, B)。さらに調べると,pleiotrophinは,脱髄状態の神経細胞に発現しており,ダメージを受けた神経軸索において輸送小胞中に存在することがわかりました(図2C)。
pleiotrophinは細胞外に分泌される細胞増殖様因子の一つです。研究グループの過去の研究から,pleiotrophinの受容体であるPTPRZは,pleiotrophinが結合することで,その働きが抑制されることがわかっていました。そこで,PTPRZを発現しないように遺伝子操作されたマウスにクプリゾン食餌を与えると,通常の野生型マウスと同じように脱髄をおこしましたが,野生型より早く回復することが判明しました(図3)。これらの結果は,損傷を受けた軸索からpleiotrophinが分泌されてPTPRZの働きを弱めることで,再ミエリン化が促されていることを示唆しています。
髄鞘を形成するオリゴデンドロサイトは,OPCs(oligodendrocyte precursor cells)と呼ばれる前駆細胞から分化・成熟します(図4A)。PTPRZ受容体は,OPCsに多く発現しており,そこでは細胞を未分化状態に留めるブレーキのように働くと考えられていましたが,そのブレーキを解除する仕組みは不明でした。研究グループは,pleiotrophinをシャーレ内で培養したマウス脳の細胞に作用させたところ,より多くのオリゴデンドロサイトへと成熟することを見出し,pleiotrophinがPTPRZのブレーキを解除するシグナルになっていることを証明しました(図4B)。
今回の研究によって,脱髄で傷ついた神経からはpleiotrophinが分泌されて,その周囲に存在するOPCsのPTPRZに作用することで,髄鞘を形成するオリゴデンドロサイトへの分化・成熟を促し,脱髄修復を効率的に進めている仕組みが明らかになりました。
【今後の展開】
本研究の成果は,多発性硬化症などの脱髄疾患において再ミエリン化を積極的に促すような薬剤として,PTPRZの働きを止める化合物の有望性を示しています。研究グループでは,このコンセプトに基づいて創薬探索研究を開始しています。
本研究の成果には,以下のようなミエリン化促進薬の探索を推進する新技術が含まれます。培養細胞を用いたバイオアッセイは,化合物の初期評価で最も重要視されるステップです。これまでミエリン化促進の評価系の多くは,実験ごとにマウスやラット脳から細胞を分離して行われてきましたが,久保山和哉研究員は,マウスからOPCsの形質を良好に保存したオリゴデンドロサイト系譜細胞(OL1細胞)を樹立しました。OL1細胞は,適切な培養下で成熟したオリゴデンドロサイトへと再現良く分化します(動画1<https://youtu.be/nqxigfwvJ4I>)。OL1細胞を評価系として用いることで,化合物の生物活性の評価の迅速化が期待できます。
動画1:オリゴデンドロサイト系譜OL1細胞
また,これまで脱髄やその回復を評価は,動物から脳を取り出し,パラフィン組織切片を作成,ルクソールファストブルー(髄鞘の染色法)などの組織染色によって行われていました。この方法は多くの時間と,熟練した技術を必要としますが,これに変わる簡便な解析手法の開発にも成功しました。藤川顕寛研究員は,取り出した脳を造影剤に浸漬し,コンピュータ断層(CT)撮影することで,脱髄の程度が定量的に評価できることを見出し,この原理を用いた評価系を実用化しました(動画2<https://youtu.be/O_ReIADiR0I>)。CT解析後のサンプルは,通常の組織解析にも利用可能であることも大きな利点です。in vivoにおける薬効評価の定量性の向上とともに,迅速化と低コスト化につながる新技術です。 今後研究グループでは,オリゴデンドロサイトの分化・成熟の制御基盤に対する基礎的理解をさらに深化させるとともに,開発した新技術を広く公開します。
動画2:X線CTによるマウス脳のイメージング解析
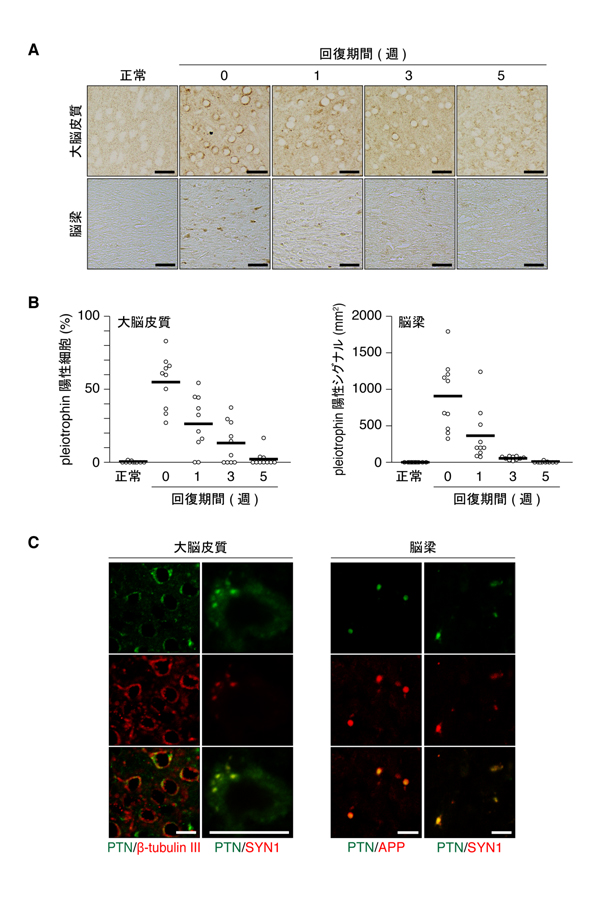
図2: クプリゾン脱髄によるpleiotrophinの一過性発現
A,B, クプリゾンを含む餌をマウスに6週間与えて脱髄を誘導した(0週)。その後,通常餌に戻し1〜5週間回復させた。正常群は通常餌のみで飼育した。大脳皮質と脳梁(髄鞘をもつ有髄繊維束の通る部位)におけるpleiotrophinの免疫組織染色(A)とその定量評価(B)。各丸はマウス1個体の数値であり,横線はそれらの平均値を示している。C, 大脳皮質および脳梁におけるpleiotrophin(緑色)とβ-tublin III(神経細胞のマーカー),シナプシン1(SYN1, 軸索小胞のマーカー),アミロイドβ前駆タンパク質(APP, 損傷神経軸索のマーカー)(赤色)の免疫蛍光染色像。最下段は上の二つの重ね合わせ。黄色は赤色と緑色のシグナルが重なっていることを示す。
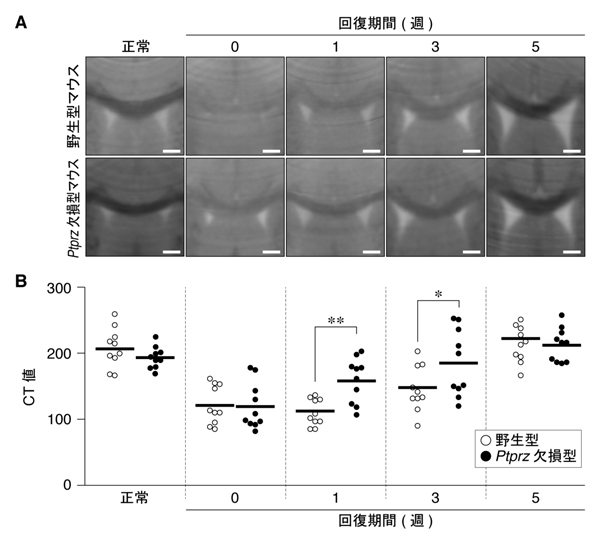
図3: Ptprz欠損マウスによる再ミエリン化の促進
A,B, 図2と同様に、野生型マウスおよびPtprz欠損マウスにクプリゾン食餌を与え,脳梁領域における脱髄の回復過程をX線CTで観察した。脱髄が進むと脳梁部のCT値が増加(黒色から白色)する。CT値の定量評価(B)。各丸はマウス1個体の数値であり,横線はそれらの平均値を示している。* P < 0.05, ** P < 0.01。
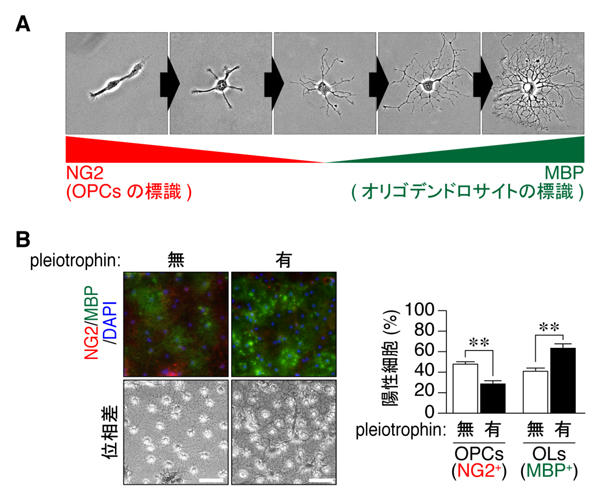
図4: Pleiotrophinによるオリゴデンドロサイトへの分化・成熟の促進
A, OPCsからオリゴデンドロサイトへの分化の様子。オリゴデンドロサイトの前駆細胞(OPCs)には,NG2というマーカー分子が多く発現している。一方,成熟したオリゴデンドロサイトでは,NG2の発現は消失し,MBPというマーカー分子が発現するようになる。分化に伴い,細胞形態は双極状から複数のプロセス(突起)が伸出し,さらに複雑な網の目状のプロセスをもつものに変化していく。B,オリゴデンドロサイトの分化に対するpleiotrophinの作用。OPCsに非常によく似た形質をもつOL1細胞をpleiotrophinの有もしくは無の状態で分化誘導した。pleiotrophin存在下では,NG2陽性のOPCs(赤色)が減り,MBP 陽性のオリゴデンドロサイト(緑色)が増えている。** P < 0.01。
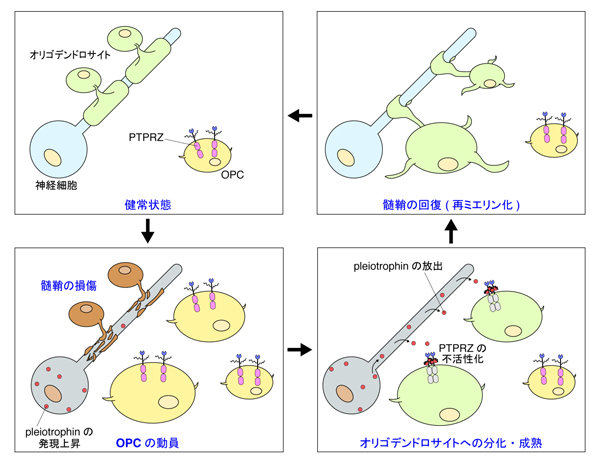
図5: 脱髄修復を促すpleiotrophin-PTPRZシグナリング
髄鞘が壊れていない状態では,PTPRZ はOPCsの未分化状態の維持に働いている(左上)。髄鞘が傷つくと,神経細胞はpleiotrophinを産生し,これを神経軸索から放出すると考えられる。また脱髄の生じた領域にはOPCsが集まってくるが,OPCsの集積にはPTPRZやpleiotrophinは関与していないようである(左下)。放出されたpleiotrophinは,OPCs上のPTPRZに結合することで分化抑制ブレーキを解除し,オリゴデンドロサイトへの分化・成熟を促し(右下),オリゴデンドロサイトが再び髄鞘をつくることで神経機能は回復する(右上)。
【発表雑誌】
米国神経科学会誌 The Journal of Neuroscience 2015年9月2日号掲載
著者:Kazuya Kuboyama, Akihiro Fujikawa, Ryoko Suzuki, and Masaharu Noda
【研究グループ】
本研究は,基礎生物学研究所 統合神経生物学研究部門の野田昌晴教授らの研究グループによって実施されました。
【研究サポート】
本研究は,日本学術振興会 科学研究費助成事業,科学技術振興機構 研究成果最適展開支援プログラム (A-STEP),および自然科学研究機構 新分野創成センターイメージングサイエンス研究分野プロジェクトの支援を受けて行われました。
【本件に関するお問い合わせ先】
基礎生物学研究所 統合神経生物学研究部門
教授: 野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846 (研究室)
E-mail: madon@nibb.ac.jp
URL: http://niwww3.nibb.ac.jp/
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp