
基礎生物学研究所




2016.07.22
基礎生物学研究所 統合神経生物学研究部門ではこれまで、タンパク質チロシンホスファターゼに属するPTPRZが脱髄疾患(多発性硬化症)や脳腫瘍(グリオーマ)に対する創薬ターゲットになることを報告してきました。コンドロイチン硫酸(CS)は、膜タンパクや分泌タンパク分子に結合して、プロテオグリカン(PG)と総称される糖タンパク質として生体内に存在しています。このコンドロイチン硫酸プロテオグリカン(CSPG)は、慢性化した多発性硬化症の脱髄巣や脊髄損傷の損傷部位に蓄積し、髄鞘や神経繊維の再生の妨げになることが知られています。
今回、同研究部門の久保山 和哉 研究員、藤川 顕寛 研究員、野田 昌晴 教授らは、髄鞘を形成するオリゴデンドロサイトというグリア細胞の細胞分化を制御しているPTPRZという酵素の活性調節に、PTPRZに結合しているコンドロイチン硫酸鎖が関与していることを明らかにしました。PTPRZのコンドロイチン硫酸鎖は、PTPRZを活性化状態(単量体)に維持する働きをしており、PTPRZの抑制性リガンド分子であるプレイオトロフィンは、コンドロイチン硫酸鎖と結合することによって、その働きを抑制することが判りました。その結果、PTPRZは不活性化(2量体化)し、オリゴデンドロサイトの分化を促進するというメカニズムが明らかになりました。
本成果は米国時間2016年7月21日に米国生化学・分子生物学会誌The Journal of Biological Chemistryに掲載されました。
【背景】
脳神経系のそのほとんどは、神経軸索が髄鞘(ミエリン鞘)で被われている有髄神経です。髄鞘は、オリゴデンドロサイト(希突起膠細胞)というグリア細胞の細胞膜が神経軸索に巻き付いて形成されています。この髄鞘が絶縁シートとして働くことで、跳躍伝導と呼ばれる非常に速い神経伝達が可能になっています。脱髄疾患では、この髄鞘の構造と機能が失われることで、四肢の麻痺や失明などを引き起こします。
髄鞘を形成するオリゴデンドロサイトは、OPCs(oligodendrocyte precursor cells)と呼ばれる前駆細胞から分化・成熟します。これまでの研究から、OPCsに発現しているPTPRZが細胞を未分化状態に留めるブレーキ役をしていることが判っています(2015年プレスリリース参照)。PTPRZは細胞膜を貫通する膜タンパク分子であり、細胞内側にタンパク質チロシンホスファターゼ(PTP)という脱リン酸化酵素活性をもっています。その細胞外領域には、コンドロイチン硫酸という糖鎖が多数、共有結合しています(図1)。
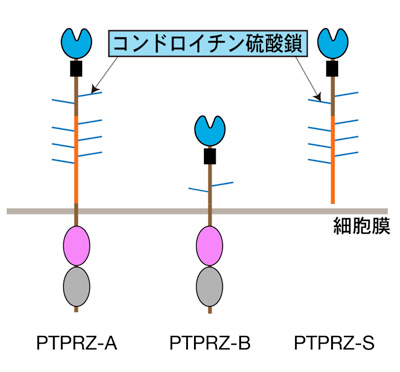
図1: PTPRZの構造
PTPRZの分子構造。PTPRZには3種類のスプライシングアイソフォームが存在する。受容体型のPTPRZ-AとPTPRZ-B、そして分泌型のPTPRZ-Sである。PTPRZ-Bの細胞外領域は、PTPRZ-AとPTPRZ-Sに存在するグリシン/セリンが豊富な領域の大部分が欠損しており、この部分に多数のコンドロイチン硫酸鎖が共有結合しているものと考えられている。
コンドロイチン硫酸鎖がタンパク質に共有結合した生体高分子は、コンドロイチン硫酸プロテオグリカン(CSPG)と呼ばれます。CSPGのほとんどは細胞外に分泌されて、細胞移動や細胞定着に必要な足場(細胞外マトリックス)を構成する成分になっています。CSPGはひざ関節などの軟骨成分としても知られていますが、脊髄損傷、脱髄疾患、ガンなどの病態に関与することでも注目されています。また、コンドロイチン硫酸は細胞膜の膜タンパクやPTPRZのような細胞膜に存在しシグナル伝達を担っている受容体を修飾していることも知られています。従って、PTPRZはCSPGの1つと言えます。しかしながら、PTPRZを始めとする受容体の活性制御において、コンドロイチン硫酸鎖がどのような働きをしているのかについては不明でした。
【研究成果】
オリゴデンドロサイト前駆細胞(OPCs)に発現しているPTPRZ受容体には、コンドロイチン硫酸鎖修飾が高度に認められます(図1)。研究チームは今回、PTPRZとそのリガンド分子によるシグナル伝達におけるコンドロイチン硫酸鎖の役割に注目しました。
PTPRZには、その細胞外領域のコンドロイチン硫酸鎖に高親和性に結合することがわかっている3種類のリガンド分子、プレイオトロフィン(PTN)、ミドカイン(MK)、インターロイキン-34(IL-34)が存在します。まず培養実験によって、それらの作用を調べたところ、3分子全てが、PTPRZ受容体の不活性化を通してOPCsからオリゴデンドロサイトへの分化を促進する活性があることが判りました。
次に、関係する分子の発達期の脳内における発現を調べました。その結果、マウス脳内で髄鞘形成(オリゴデンドロサイトの分化)が始まる生後10日齢において、3つのリガンド分子の中でPTNのみが一過性に発現上昇することが判りました(図2)。また、2種類存在するPTPRZの受容体アイソフォーム(図1参照)の内でPTPRZ-Aアイソフォームだけが、生後5日から10日齢で発現ピークを示していました(図2)。このことは、生体内ではPTNとPTPRZ-A受容体のペアが、OPCsの分化のタイミングを調節していることを示唆しています。実際に、PTPRZ遺伝子をノックアウトしたマウスでは髄鞘形成の時期が早まっていました(2012年プレスリリース参照)。今回、予想通り、PTNのノックアウトマウス(名古屋大学医学部の村松 壽子 先生からの提供)では反対に、髄鞘形成が遅れていることが確認されました(図3)。
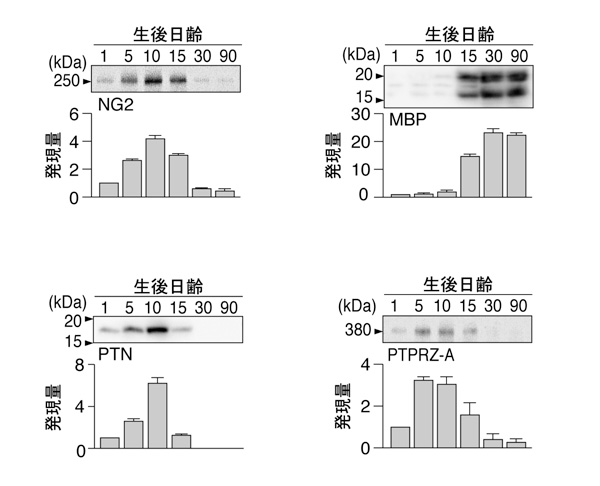
図2: マウス脳発達期におけるPTPRZおよびリガンド分子の発現変化
野生型マウスの生後1日から90日齢の全脳組織でウエスタンブロット解析を実施した。オリゴデンドロサイト前駆細胞(OPCs)のマーカーであるNG2は生後10日齢に発現ピークを示す。一方、成熟オリゴデンドロサイトのマーカーで髄鞘の構成タンパク質であるミエリン塩基性タンパク質(MBP)は生後15日齢から急激に増加する。つまりマウス脳内では、生後10日齢から髄鞘形成が一斉に開始されている。リガンド分子のうちプレイオトロフィン(PTN)とPTPRZ-Aアイソフォームは、生後5日から10日齢に発現ピークを示す。
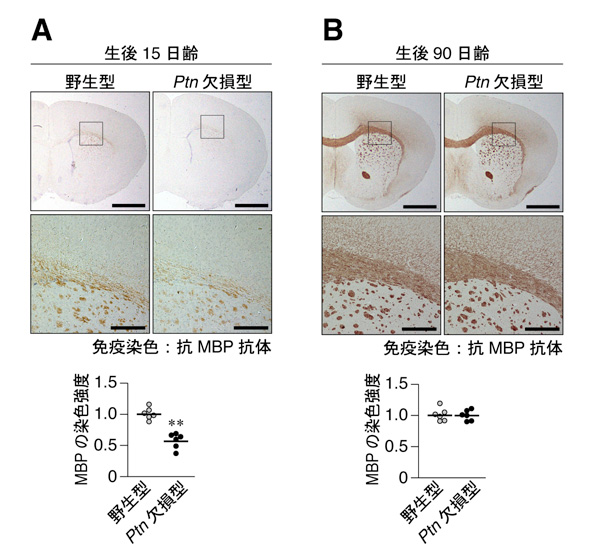
図3: プレイオトロフィン(PTN)欠損マウスにおける髄鞘構成タンパク質の発現変化
ミエリン塩基性タンパク質(MBP)の発現解析。髄鞘形成が始まっている生後15日齢(A)および成熟した生後90日齢(B)の野生型マウス並びにPTNの欠損マウスの脳組織の抗MBP抗体染色像。下図は上図の四角エリアの拡大。Ptn欠損マウスではMBPの発現開始が遅れている。スケールバー: 1 mm(上)または200 µm(下)。下段グラフはMBP染色強度の定量評価。**p < 0.01。
PTNなどのリガンド分子は、コンドロイチン硫酸鎖を介してPTPRZに高親和性に結合します。従ってPTPRZ受容体からこの糖鎖を除去すれば、リガンド分子の作用を受けなくなると推測されました。そこで、コンドロイチン硫酸鎖を酵素消化したところ、予想とは逆に、コンドロイチン硫酸鎖を除去するだけで、リガンド分子で刺激した時と同様に、PTPRZの活性が阻害され、オリゴデンドロサイトへの分化が促進することが判明しました(図4)。
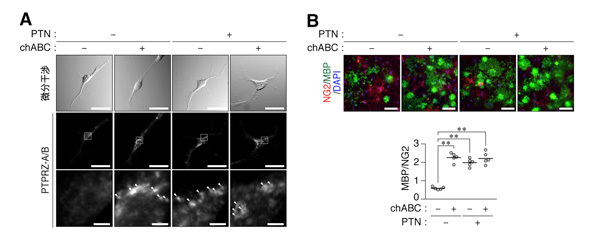
図4: コンドロイチン硫酸鎖の除去によるPTPRZの集積とオリゴデンドロサイト分化の促進
A, マウスオリゴデンドロサイト系譜OL1細胞が生育している培養ディッシュにコンドロイチナーゼABC(chABC)とプレイオトロフィン(PTN)を、図に示した組み合わせで加えてから1時間静置した。その後、細胞表面上のPTPRZ受容体の分布をPTPRZの細胞外領域に対する特異抗体を用いた蛍光染色によって可視化した。PTNで処理するとPTPRZ受容体は集積したクラスターとして検出される。一方、chABC処理でもPTPRZクラスターが同様に誘導される。PTNとchABCを一緒に添加しても相乗的な効果は認められない。スケールバー: 100 µm(上および中)または10 µm(下)。
B, 図に示した組み合わせでchABCおよびPTNを加えた分化用培地でOL1細胞を10日間ほど培養した。その後、未分化マーカーであるNG2陽性のオリゴデンドロサイト前駆細胞(OPCs、赤く染色された細胞)から、成熟したミエリン塩基性タンパク質(MBP)陽性のオリゴデンドロサイト(緑色で染色された細胞)への分化を免疫蛍光染色で評価した。グラフは、MBP陽性細胞数とNG2陽性細胞数の比率を表しており、この値が高いほどオリゴデンドロサイトへの分化が進んでいると判断される。chABC処理単独でも分化が促進していることが判る。スケールバー: 100 µm。**p < 0.01。
X線タンパク質結晶解析の結果から、PTPRZの細胞内PTP活性は、PTPRZがモノマー(単量体)として存在するときは活性状態であり、ダイマー(2量体)を形成すると不活性状態となること、そのときの立体配置として"head-to-toe dimer model"モデルが提唱されています。今回の結果は、PTPRZのコアタンパク質はそれ自身で会合する性質をもっていること、リガンドが結合していない状態のコンドロイチン硫酸鎖はPTPRZ同士が会合することを妨げる役割を担っていることを示しています(図5)。コンドロイチン硫酸鎖に存在する多数の硫酸基は強い負電荷を持っており、その静電気的な反発作用によって、受容体の会合が妨げられていると考えられます。一方、リガンド分子のPTNやMKは、正電荷をもつ塩基性アミノ酸のクラスター構造を有しています。細胞外からPTNやMKがコンドロイチン硫酸鎖に結合すると、両者の電荷が相殺されてダイマー化(不活性化)すると推測できます(図5)。このように糖鎖の特性を利用して細胞分化のタイミングを規定する、受容体活性の制御機構が明らかになったのは初めてのことです。
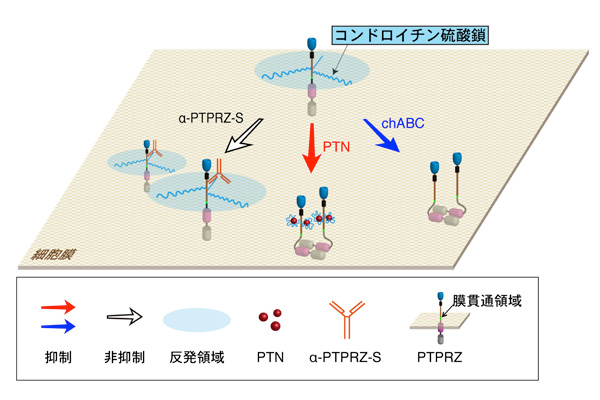
図5: コンドロイチン硫酸鎖によるPTPRZ受容体の活性調節機構のモデル
PTPRZ受容体の細胞内ホスファターゼ(PTP)活性は、モノマー(単量体)として存在するときは活性状態、ダイマー(2量体)を形成すると不活性状態と考えられている。PTPRZのコンドロイチン硫酸鎖は、その負電荷の反発力によって周囲のPTPRZ受容体を遠ざけていると考えられる。プレイオトロフィン(PTN)などのリガンド分子は、コンドロイチン硫酸鎖の負電荷性を中和して受容体のダイマー化を促進し、細胞PTP活性を不活性化すると考えられる。
オリゴデンドロサイト前駆細胞(OPCs)やラットC6グリオブラストーマで発現しているPTPRZ-AおよびPTPRZ-Bアイソフォームは、どちらもコンドロイチン硫酸鎖で高度に修飾されている。本来PTPRZを発現していないBHK-21細胞などにPTPRZ-Bアイソフォームを強制発現させた場合、コンドロイチン硫酸鎖による修飾レベルは著しく低いことが判った。本研究では、低レベルのコンドロイチン硫酸鎖の修飾であれば、PTPRZの細胞外のタンパク質構造を認識する特異抗体によっても、受容体の会合による不活性化が誘導されることが明らかになった。
【今後の展開】
コンドロイチン硫酸は、慢性化した多発性硬化症などの脱髄疾患の脱髄巣や脊髄損傷の傷害部位に蓄積し、神経繊維や神経髄鞘の再生の妨げになることが判っています。そこで、コンドロチン硫酸鎖を除去、あるいはその性質や状態を変えることによって、神経再生を促すことを目指す糖鎖標的医薬が検討されています。今回の成果は、コンドロイチン硫酸によって髄鞘や神経の再生が損なわれるメカニズムの一端を説明していると考えられます。さらに今回の結果は、コンドロイチン硫酸鎖に結合して、その電荷を中和する化合物や天然物が再生医療に応用できる可能性を示唆しています。
【発表雑誌】
米国生化学・分子生物学会誌 The Journal of Biological Chemistry 2016年7月21日掲載
著者:Kazuya Kuboyama, Akihiro Fujikawa, Ryoko Suzuki, Naomi Tanga, and Masaharu Noda
【研究サポート】
本研究の一部は、日本学術振興会の科学研究費補助金若手研究B(代表研究者:久保山 和哉 研究員)および文部科学省の科学研究費補助金・新学術領域研究「統合的神経機能の制御を標的とした糖鎖の作動原理解明」の公募研究(研究代表者:藤川 顕寛 研究員)による支援を受けて行われました。
【本件に関するお問い合わせ先】
基礎生物学研究所 統合神経生物学研究部門
教授: 野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846 (研究室)
E-mail: madon@nibb.ac.jp
URL: http://niwww3.nibb.ac.jp/
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp