
基礎生物学研究所




2012.05.09
基礎生物学研究所・統合神経生物学研究部門の新谷隆史准教授と野田昌晴教授らは、APC2 (Adenomatous polyposis coli 2)という脳神経系に発現する分子の機能を明らかにする研究を進めています。同グループでは、APC2遺伝子を欠失させたマウス(APC2を働かなくしたマウス)を作成し、その脳における異常を解析しました。その結果、APC2を欠失したマウスの脳では、神経細胞の移動に異常があり、大脳皮質、海馬、小脳などの様々な領域で、神経細胞の正常な層構造が形成されないことを見出しました。さらに詳しい解析の結果、APC2が細胞外の細胞移動を導く情報を、細胞運動に必須である細胞骨格(アクチン骨格・微小管)のダイナミクス(形成・分解・安定化)に正しく反映させるという重要な役割を果たしていることが明らかになりました。このようなメカニズムで、脳の層形成に必須の役割をしている分子が明らかになったのは初めてのことです。APC2を欠損したマウスは、運動機能の異常や、てんかん発作などの異常を示すことから、ヒトにおいて神経細胞の移動の異常によって生じる疾患が発症する仕組みや、それらの治療法の開発につながる可能性があります。この成果は、5月9日に神経科学専門誌 Journal of Neuroscience に掲載されます。
[研究背景]
個体の発生過程において、神経管の内側で細胞分裂により誕生した未分化な神経細胞は、外側に向かって移動し正しい位置で止まることによって、脳が形成されます。移動中の神経細胞は、細胞外に分布する神経細胞を誘引、あるいは反発させる因子に応答して、正しい経路を選択することで、目的の場所に到達すると考えられています。一方、細胞内では、アクチンや微小管などから構成される細胞骨格のダイナミクスが細胞移動に必須の働きをしています。細胞表面で受け取った誘引因子や反発因子の情報は、最終的に細胞骨格に伝えられることで、それらの因子に応答した適切な細胞移動が生じると考えられています。しかしながら、このような細胞外からの情報を細胞骨格に伝える仕組みはよく分かっていません。
APC2は構造が、癌の発生を抑制する遺伝子であるAPCに類似した分子ですが、全ての細胞で発現するAPCとは異なり、主に神経系に発現しています。研究グループは以前に、APC2が微小管に結合し、その安定性を制御することを明らかにしていました。また、ニワトリの視神経投射系を用いた実験により、神経の軸索が正しい場所へ伸長する上で重要な役割を果たしていることを明らかにしていました。
[研究成果]
研究グループは、今回、APC2遺伝子欠損マウスを作製し、脳神経系の異常について解析を行いました。その結果、大脳皮質、海馬、小脳、嗅球などの様々な脳の領域で、層構造が正常に形成されていないことを見出しました(図1)。また、これらの層構造の異常は、誕生した神経細胞が秩序だった細胞移動を行えず、ランダムに移動することによって生じたことを明らかにしました。
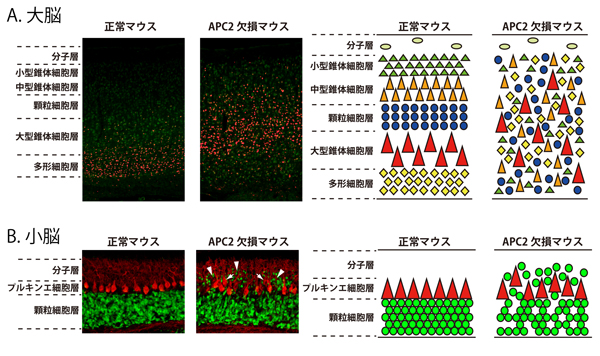
図1: APC欠損マウスの脳で観察される層構造の異常
A.正常マウスの大脳は、異なる神経細胞集団が積み重なったきれいな層構造をしていますが、APC2を欠損したマウスでは、これらの細胞集団が混じり合って分布しています。左図は多形細胞の染色像を示していますが、正常マウスにおいて多形細胞は最下層に分布するのに対して、APC2 欠損マウスにおいては他の層にも広く分布します。右の模式図は、様々な解析から明らかになった両マウスの大脳における神経細胞の分布を示しています。
B.正常マウスの小脳では、プルキンエ細胞と顆粒細胞が異なる層を作っていますが、APC2欠損マウスでは、プルキンエ細胞の配置が乱れると共に(矢印)、多数の顆粒細胞が分子層に分布しています(矢頭)。
発生期のAPC2欠損マウスの脳より神経細胞を取り出し、細胞移動について詳細な解析を行ったところ、APC2を欠損した神経細胞は、移動能(スピード等)の基本的な能力は保持していましたが、誘引性因子や反発性因子に応答して、運動を制御する能力を欠いていることを見出しました。また、APC2が微小管に加えて、アクチン骨格にも結合し、その制御を行うことも新たに見出しました。APC2はこのように、細胞外の情報を細胞骨格の制御に正しく伝えるという、非常に重要な役割を果たしていると考えられます(図2)。これまで、誘因性因子や反発性因子の欠損、それら因子の受容体の異常、細胞骨格自身の形成異常等で正しい細胞移動が起こらないという報告はありましたが、今回のように情報の伝達に関わる分子が同定されたのは初めてのことです。
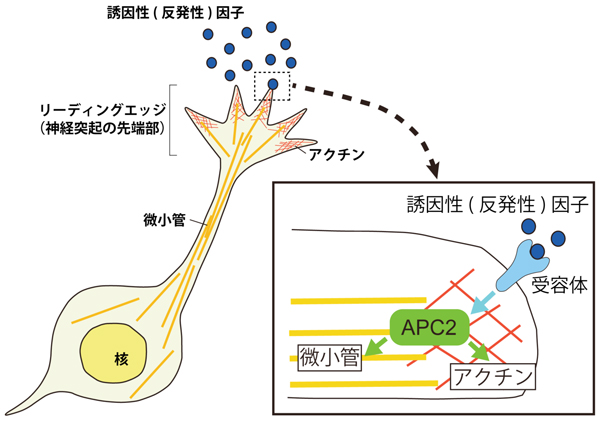
図2:予想されるAPC2のはたらき
移動中の神経細胞では、リーディングエッジ(神経突起の先端部)が移動する方法を決定しています。誘因性、あるいは反発性因子は、リーディングエッジの細胞膜上に存在する受容体に結合し、APC2へ情報を伝えます。APC2は、受け取った情報に従って、リーディングエッジ内の微小管およびアクチンの生成・分解・安定性等を制御していると考えられます。
APC2欠損マウスは、運動機能の異常や、てんかん発作などの異常を示すことから、ヒトにおいても神経細胞の移動の異常によって同様の疾患が発症すると考えられます。その発生の仕組みや、治療法の開発につながる可能性があります。
[発表雑誌]
神経科学専門誌 Journal of Neuroscience 5月9日号掲載
論文タイトル:Directional Neuronal Migration Is Impaired in Mice Lacking Adenomatous Polyposis Coli 2
著者:Takafumi Shintani, Yasushi Takeuchi, Akihiro Fujikawa, Masaharu Noda
[研究グループ]
本研究は、基礎生物学研究所 統合神経生物学研究部門の野田昌晴教授と新谷隆史准教授が中心となって実施されました。
[研究サポート]
本研究は、文部科学省科学研究費補助金のサポートを受けて行われました。
[本件に関するお問い合わせ先]
基礎生物学研究所 統合神経生物学研究部門
教授: 野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846(研究室)
E-mail: madon@nibb.ac.jp
URL: http://niwww3.nibb.ac.jp/
[報道担当]
基礎生物学研究所 広報室
Tel: 0564-55-7628 Fax: 0564-55-7597
E-mail: press@nibb.ac.jp