大阪大学
自然科学研究機構 基礎生物学研究所
三重大学
【研究成果のポイント】
・可逆的に光る蛍光タンパク質
※1(ddGFP
※2)を利用し、細胞同士が触れ合う瞬間をリアルタイムに捉える新規センサー「Gachapin」および「Gachapin-C」を開発
・従来の技術では見落とされていた、一過的な細胞接触や、自分自身の突起同士が触れ合う「自己接触」の可視化に成功
・神経回路形成の鍵を握る動的な細胞接触や自己接触の可視化を通じ、生命現象の深い理解のみならず、その異常が関わる脳疾患のメカニズム解明や新たな治療戦略の創出への貢献に期待
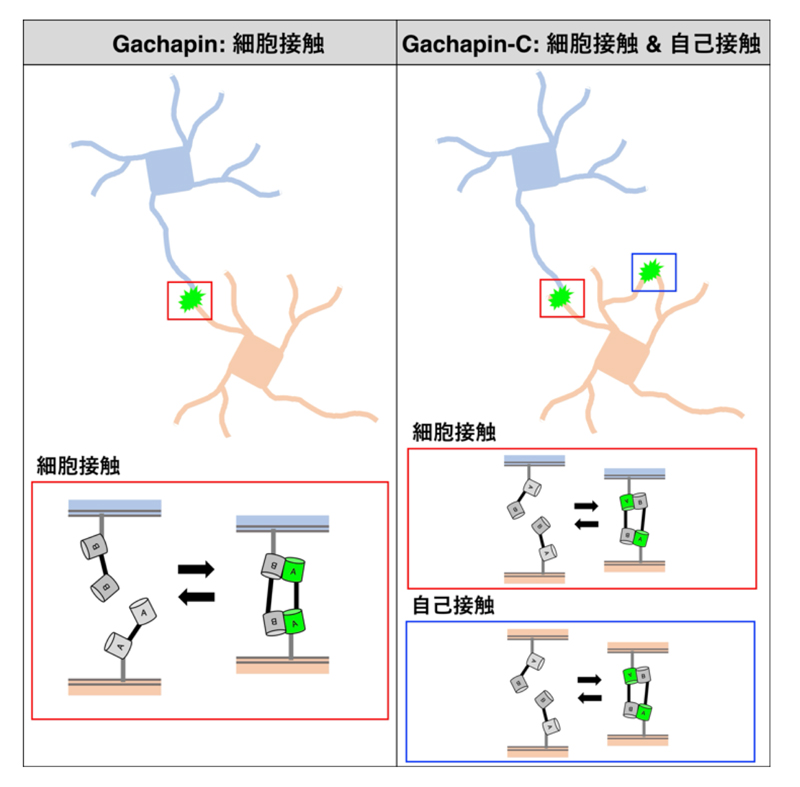
図1 GachapinとGachapin-Cによる細胞接触と自己接触の可視化
【概要】
大阪大学産業科学研究所の京卓志特任研究員(常勤)(現 招へい研究員/兼 基礎生物学研究所助教)、永井健治教授(兼 大阪大学先導的学際研究機構超次元ライフイメージング部門 教授)、同大学院生命機能研究科の星野七海助教(現 招へい教員)、八木健教授、橋本秀彦助教(現 招へい教員)、三重大学大学院医学系研究科の實木亨准教授からなる研究グループは、細胞同士のダイナミックな接触をリアルタイムで可視化する新しい蛍光センサー「Gachapin」および「Gachapin-C」を開発しました(
図1)。
細胞間の接触は生命活動の根幹を支える重要な現象ですが、従来の技術では一度接触すると光り続けてしまう等の制約があり、刻一刻と変化する「動的な接触」や、自分自身の突起同士が触れあう「自己接触」を捉えることが困難でした。
本研究では、可逆的に結合・解離する蛍光タンパク質(ddGFP)を応用することで、接触の形成と解消を鋭敏に反映するセンサーを構築しました。これにより、細胞移動における一過的な接触や、1つの神経細胞から複数伸びる神経突起間の一過的な自己接触の可視化に成功しました。
本研究成果は、米国科学誌 『Cell Reports Methods』(オンライン)に、1月23日(金)(現地時間)に公開されました。
【京卓志招へい研究員のコメント】
「細胞がどこで、いつ、どれだけの時間触れているかを、そのままの時間分解能で見たい」というニーズに応えるために開発しました。Gachapinは既存法では見えにくかった細胞同士が離れる瞬間も追跡できます。Gachapin-Cは同一細胞内の突起同士の接触も捉えられるため、神経細胞の自己回避など、これまで解析が難しかった現象の理解が進むことを期待しています。
【研究の背景】
多細胞生物において、細胞同士の接触は情報の受け渡しの現場であり、個体発生や免疫応答、神経ネットワークの構築において中心的な役割を果たします。特に神経細胞は、多くの突起を伸ばし他者と接触する一方で、自分自身の突起同士は適切に回避(自己回避
※3)することで精緻な回路を形成します。しかし、これまでの可視化手法(split-GFP
※4技術)は、一度接触して光るとその状態が保持されてしまう「不可逆性」や、接触してから光りだすまでに時間がかかるという課題があり、ダイナミックな接触動態を正確に観察することは困難でした。
本研究では、二量体化によって蛍光強度が変化する蛍光タンパク質「ddGFP」を利用し、接触の形成と解消をそのまま追跡できる蛍光センサーの開発を目指しました。
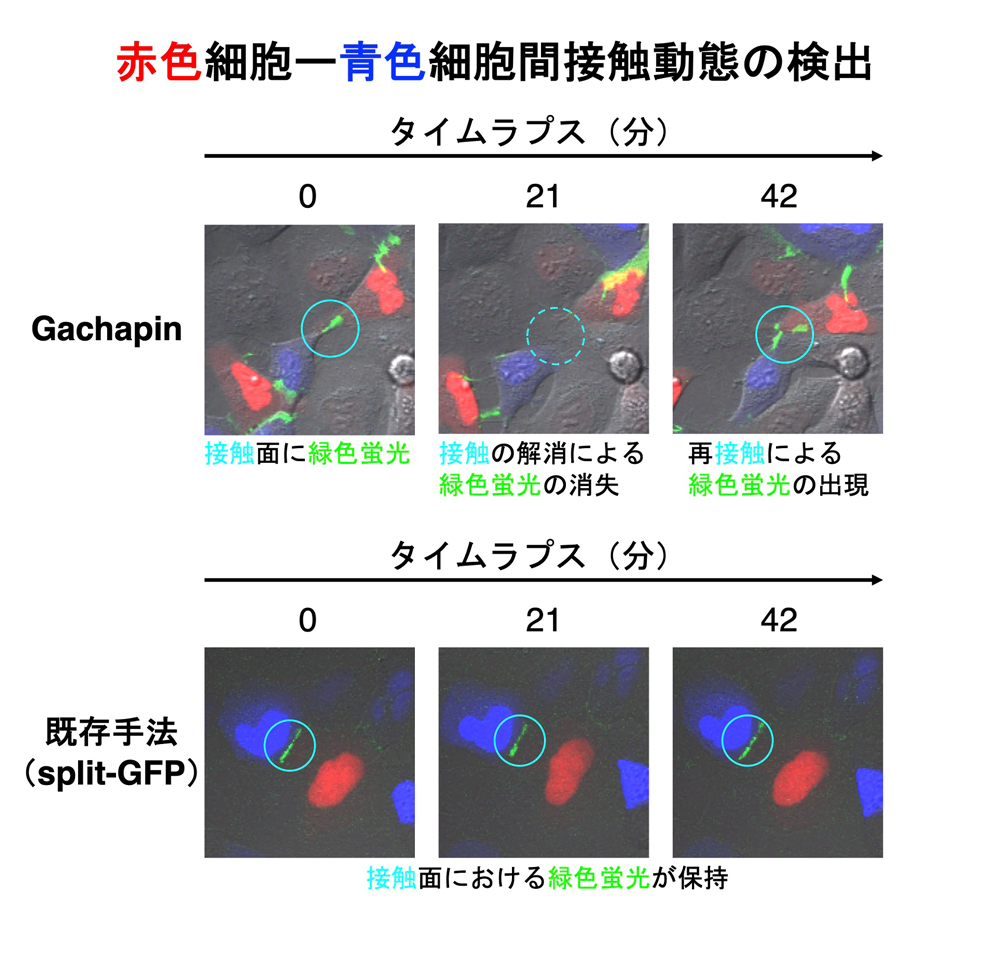
図2 Gachapinによる細胞接触動態の可視化と既存手法との比較
【研究の内容】
研究グループは、細胞膜表面に提示した2つのddGFP成分が、細胞同士が接触したときにのみ結合して蛍光を発する設計により、二成分型の接触センサー「Gachapin」を構築しました。この名称は、分子設計に基づき名付けた「
GPI-
anchored
cell–cell contact indicator by
heterodimerization of ddGFP-
A and ddFP-B
prote
ins」の下線部分から取ったものです。
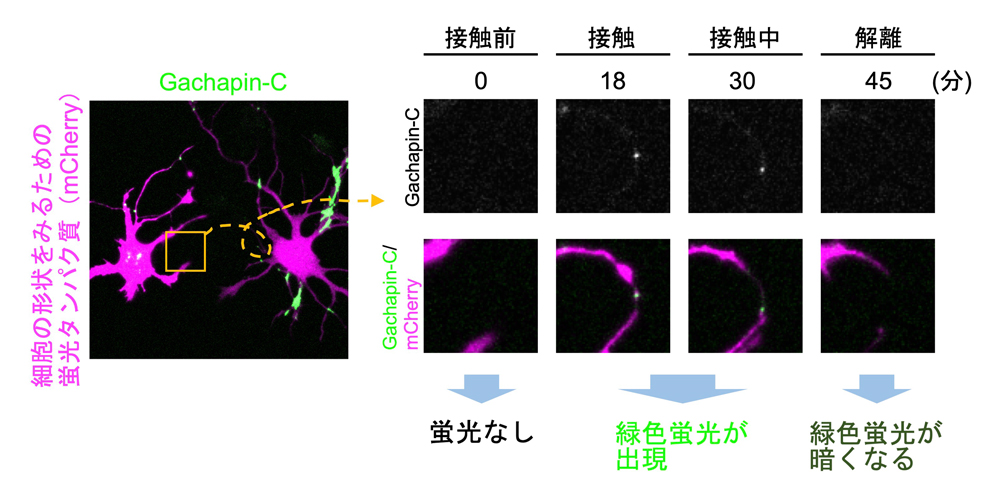
図3 Gachapin-Cによる神経細胞の自己接触の可視化
運動性の高い細胞でのタイムラプス観察により、接触の形成・解消がGachapinで追跡できること、split-GFP技術に基づく接触センサーでは同条件で接触解消が追跡しにくいことを示しました(
図2)。また、Gachapinを他の蛍光センサーと併用することで、細胞接触のダイナミクスと、それに連動する細胞内の骨格構造や情報伝達の動きを同時に捉えることにも成功しました。神経細胞においても、神経突起同士の接触部位でGachapinが特異的に光り、突起同士が触れては離れる動態を観察できることも示しました。
さらに、研究グループは、たった1つの成分で機能する進化型センサー「Gachapin-C」の開発にも成功しました。これは、細胞表面に存在する細胞接着分子
※5の一部に、開発した蛍光センサーの部品を巧妙に組み込んだ設計です。最適化により、接触していないときの不要な蛍光を極限まで抑え込む工夫が施されています。その結果、従来の技術では困難だった、1つの細胞から伸びる複雑な突起同士が触れ合う「自己接触」を鮮明に可視化することに成功しました(
図3)。
【本研究成果が社会に与える影響(本研究成果の意義)】
「Gachapin」は、特定の分子メカニズムに依存せず、細胞の表面が物理的に触れ合う「接触」そのものを汎用的に可視化できる強力なツールです。そのため、発生における組織形成、免疫細胞の動態、そして複雑な脳神経回路の構築といった、多岐にわたる生命現象の解明を加速させると期待されます。とりわけ、「Gachapin-C」は、従来の技術では捉えられなかった、1つの細胞から伸びる突起同士の「自己接触」を可視化できる画期的なツールです。神経細胞が適切なネットワークを築くために不可欠な「自己回避」などのプロセスをライブで解析可能にすることで、神経発達障害や精神疾患のメカニズム解明に新たな光を当てることが期待されます。
【特記事項】
本研究成果は、2026年1月23日(金)(現地時間)に米国科学誌 『Cell Reports Methods』 (オンライン)に掲載されました。
タイトル:“Fluorescent indicators for visualizing dynamic contact between cells and between processes originating from a single cell”
著者名:Takashi Kanadome, Natsumi Hoshino, Susumu Jitsuki, Hidehiko Hashinmoto, Takeshi Yagi, and Takeharu Nagai
DOI:
https://doi.org/10.1016/j.crmeth.2025.101292
なお、本研究は、JST戦略的研究推進事業さきがけ「多細胞システムにおける細胞間相互作用とそのダイナミクス(JPMJPR2045)」研究の一環として行われました。
【用語説明】
※1 蛍光タンパク質
蛍光を発するタンパク質の総称。2008年のノーベル化学賞で知られる下村修博士らが、1962年にオワンクラゲから初めて遺伝子を単離し、緑色蛍光タンパク質(Green Fluorescent Protein, GFP)と命名した。
※2 ddGFP
dimerization -dependent green fluorescent proteinの略。
ddGFP-AとddFP-Bからなる蛍光タンパク質。ddGFP-A単独では光らないが、ddFP-Bと異種二量体を形成することで緑色蛍光を生じるようになる。Gachapinでは細胞間接触によりddGFP-AとddFP-Bが近づくと異種二量体が形成される。この反応は可逆的であり、近年様々な蛍光センサー開発に利用されている。
※3 自己回避
1つの神経細胞から伸びる複数の突起(樹状突起や軸索)が、互いに重なり合うのを避けて広がる現象。これにより、神経細胞は限られたスペースの中で自身の突起を効率よく分散させ、より広い範囲から情報を効率的に受け取ることが可能になる。精緻な脳のネットワークを構築するために不可欠なプロセス。
※4 split-GFP
2つのタンパク質間の相互作用を解析するために登場した技術で、GFPを二分割して得られる非蛍光性の断片のそれぞれを、解析対象のタンパク質に融合し、対象タンパク質間の相互作用に伴って再構成されたGFPから発せられる蛍光によってタンパク質間相互作用を検出する。
※5 細胞接着分子
細胞表面に発現し、細胞同士の接着を仲介するタンパク質の総称。これまでに数百種発見されている。
【参考URL】
京 卓志 招へい研究員 researchmap
https://researchmap.jp/kanadome
【本件に関する問い合わせ先】
<研究に関するお問い合わせ>
大阪大学 産業科学研究所 招へい研究員(基礎生物学研究所 助教)
京 卓志(かなどめ たかし)
<広報に関するお問い合わせ>
大阪大学 産業科学研究所 広報室
基礎生物学研究所 広報室
TEL: 0564-55-7628 FAX: 0564-55-7597
E-mail: press@nibb.ac.jp
三重大学 企画総務部総務チーム 広報・渉外室







