基礎生物学研究所の及川和聡 元研究員、近藤真紀 技術職員、木森義隆 元特任助教(現 福井工業大学)、真野昌二 准教授、西村幹夫 名誉教授 (元甲南大学 研究員)、ヤギェウォ大学の後藤志野 研究員、山田健志 研究室長、新潟大学の林八寿子 准教授、加藤朗 准教授、甲南大学の上田晴子 准教授、西村いくこ 名誉教授らを中心とした国際共同研究チームは、岩手大学の高橋大輔 研究員・上村松生 教授、東京工業大学の大隅良典 栄誉教授、京都大学の沼田圭司 教授らと共同で、オートファジーが、活性酸素種(ROS)の蓄積したペルオキシソームを優先的に分解することで、強光下で生じる植物細胞への傷害を軽減し、植物の生存に寄与していることを発見しました。また、オートファジーに関わるタンパク質ATG18が、分解されるペルオキシソームを特異的に標識することを示しました。さらに、分解されるペルオキシソームがオートファゴソーム膜に囲まれ液胞に輸送されるマクロペキソファジーに加え、液胞膜で覆われ、液胞内部に輸送されるミクロペキソファジーが誘導される可能性を示しました。この様子は単離液胞を用いた解析により明確に確認されました。
上記の成果は、光条件下におけるオートファジー変異体の生理解析と、共焦点顕微鏡と電子顕微鏡を用いたイメージング解析、そして生化学的手法を活用し、それらを統合して解析することで、植物におけるペキソファジーの重要な役割を明らかにすることに成功しました。
本研究成果は、国際科学誌『Nature Communications』に2022年12月5日付で掲載されました。
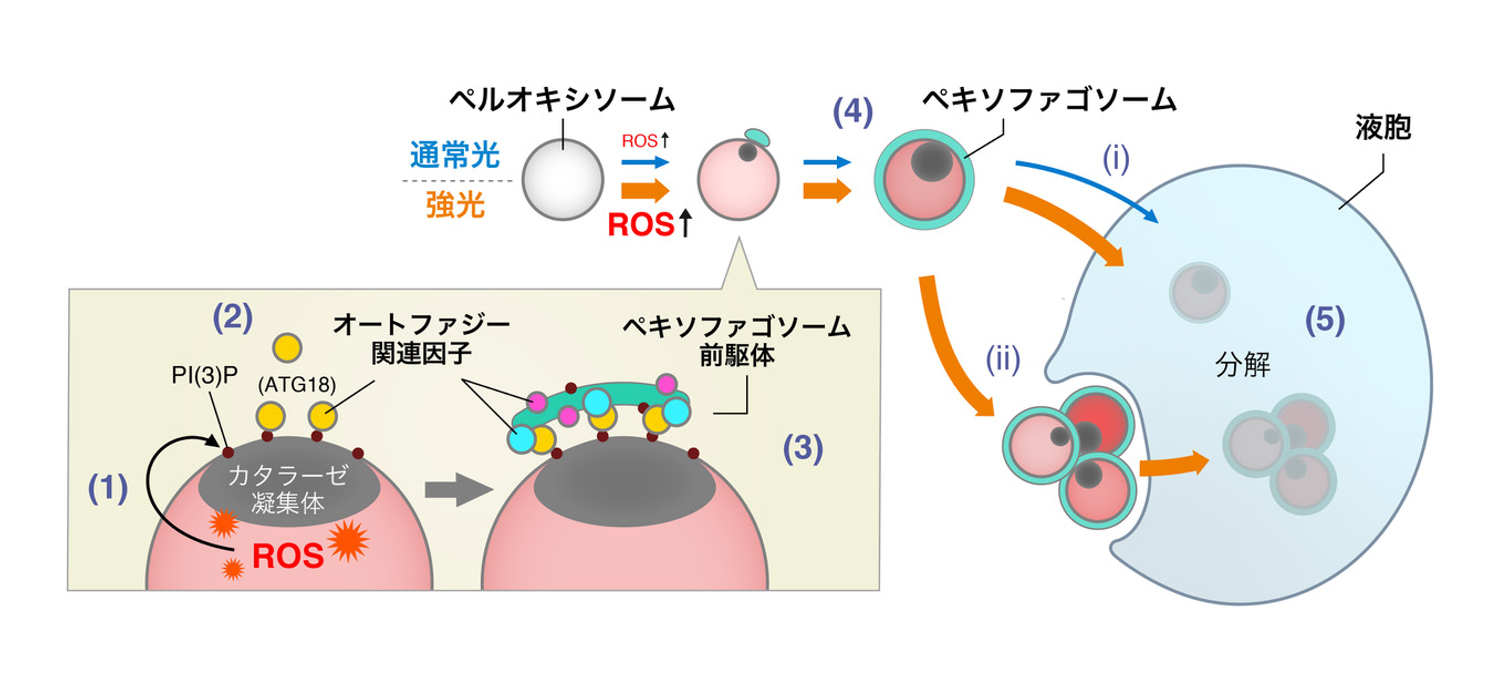 図1. オートファジーによるペルオキシソーム分解機構の模式図
図1. オートファジーによるペルオキシソーム分解機構の模式図
活性酸素種(ROS)の蓄積したペルオキシソーム内部には、活性の低下したカタラーゼの凝集が生じる(1)。その近辺にホスファチジルイノシトール-3-リン酸(PI(3)P)の形成とATG18の集積が生じる(2)。他のオートファジー関連因子と協調して、オートファゴソーム膜がペルオキシソームを包む(3)。マクロペキソファジー(i)とミクロペキソファジー(ii)により液胞へ輸送され分解される。
【
本研究のポイント】
・ 植物の強光下におけるペキソファジーの役割や
ペルオキシソーム(用語1)の分解機構はよくわかっていませんでした。
・
オートファジー(用語2)因子ATG18aにGFPを融合させた遺伝子(ATG18a-GFP)をオートファジー変異体で発現させたところ、未分解のペルオキシソームが優先的に標的化されました。
・ 強光下で植物の生育解析を行うと、
atg2,
atg7変異体では、
活性酸素種(ROS)(用語3)の蓄積を伴った葉の傷害(クロロフィルの分解)と葉肉細胞において多数のペルオキシソームによる巨大な凝集体の形成が観察されました。また、ペルオキシソームタンパク質のカタラーゼが不溶性画分に多く蓄積することが確認されました。このペルオキシソームの凝集体にはATG18a-GFPの集積が確認されました。
・ 液胞膜タンパク質Vam3と蛍光タンパク質Venusとの融合遺伝子(Venus-Vam3)で液胞を可視化すると、変異体ではペルオキシソームの凝集体を取り囲む構造体が、野生株では液胞内へ移行するペルオキシソームが観察されました。単離液胞での解析においても同様な現象がより鮮明に確認されました。
・ カタラーゼやATG18aを過剰に発現させると、強光下での植物の傷害やROS蓄積を抑制しました。
【研究の背景】
過剰な光は、植物にとってはストレスとなり、光阻害等の傷害を細胞内部に生じさせます。ペルオキシソーム 、ミトコンドリア、葉緑体が担う
光呼吸(用語4)は、光阻害を抑制しますが、同時にペルオキシソーム内に活性酸素種(ROS)が蓄積し、ROSの一つである過酸化水素を分解するカタラーゼの活性低下が生じます。
オートファジーは、ROS等で傷害を受けたオルガネラを液胞(動物ではリソソーム)で分解することが知られています。前回、本研究グループは、植物の酸化状態の高いペルオキシソームがオートファジーにより分解される
ペキソファジー(用語5)について報告しました(Shibata et al, 2013; Yoshimoto et al, 2014)。酵母や動物の主要なオートファジー因子は、植物にも保存されており、ペキソファジーにも関与していることがわかりました。酵母や動物では、ペキソファジーの分子機構(受容体やオートファゴソーム形成機構)に関する論文も複数報告されていますが、巨大な液胞をもつ植物では、酵母や動物と同様な分子機構でペルオキシソームが分解されるかは、不明でした。また、強光条件下でのペキソファジーの役割についても良くわかっていませんでした。
【研究内容】
1. オートファジー因子によるペルオキシソームの優先的標的化
ATG18は、オートファジー関連因子の1つで、他の因子と協調して、オートファゴソーム膜形成初期の足場を形成することが酵母や動物の研究から明らかになっています。そこで、シロイヌナズナの野生株とオートファジー変異体(
atg2、
atg7)にATG18a-GFPを発現させたところ、ペルオキシソームが優先的に認識されることが共焦点顕微鏡と免疫電顕の解析から明らかになりました(図2)。
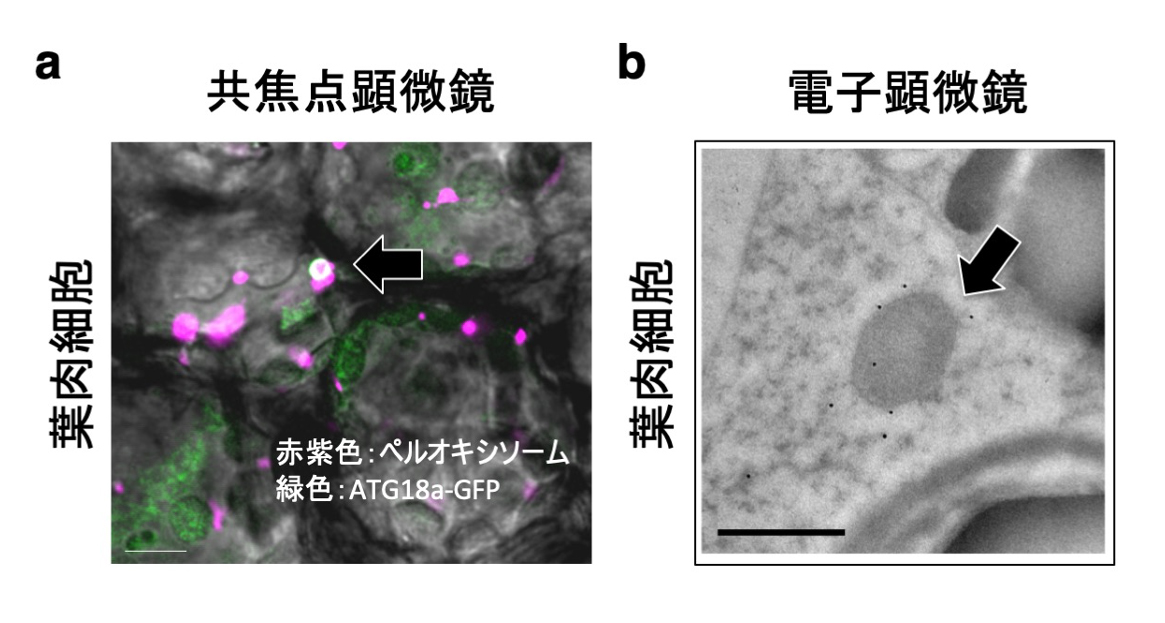 図2.
図2. ATG18a-GFPによる分解ペルオキシソームの認識
(a) ATG18a-GFPにより認識されたシロイヌナズナ野生株葉肉細胞内の分解過程にあるペルオキシソーム(黒矢印)。スケールバー:5 µm (b)ATG18a-GFPを発現する
atg2変異体株では、未分解のペルオキシソーム膜周辺に黒い金粒子が観察される(GFP抗体による免疫電顕像)(黒矢印)。スケールバー:2µm
2. 強光ストレスによるオートファジー変異体への影響
強光の影響を調べるために、オートファジー変異体を用いた成長解析を行いました。変異体では、野生株に比較して葉のクロロフィル量の低下と傷害が生じました(図3a)。そこで、細胞内の観察を行うと、ペルオキシソームの巨大な凝集体が形成され (図3b)、活性が低下したカタラーゼが過剰に蓄積していました(図3c)。
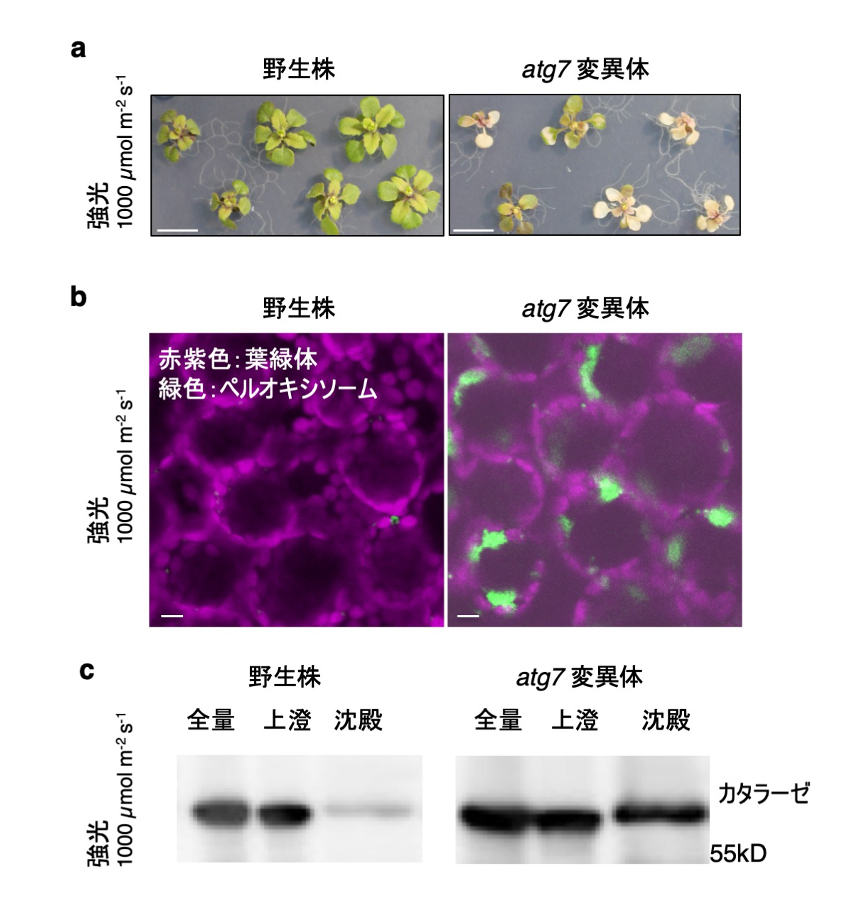 図3.
図3. 強光ストレスで生じたペルオキシソームの巨大凝集体
(a) 強光で変異体に生じた葉の傷害。 (b) 強光により形成されたペルオキシソームの巨大凝集体(緑色)。スケールバー:10 µm (c) イムノブロットによるカタラーゼ量の比較。沈殿画分には、活性の低下したカタラーゼが蓄積する。
この巨大なペルオキシソームの凝集体にもATG18a-GFPが集積しました(図4a)。そこで、ROSを特異的に染色する試薬を用いて解析すると、ペルオキシソーム の巨大凝集体が強く染色されました(図4b)。これらの結果から、変異体の葉細胞内では強光下において、不活性化したカタラーゼとROSを蓄積した本来分解されるべきペルオキシソームが過剰に凝集していることが明らかになりました。論文中では、これらの現象がカタラーゼやATG18aの過剰発現により抑制されることも示しました。
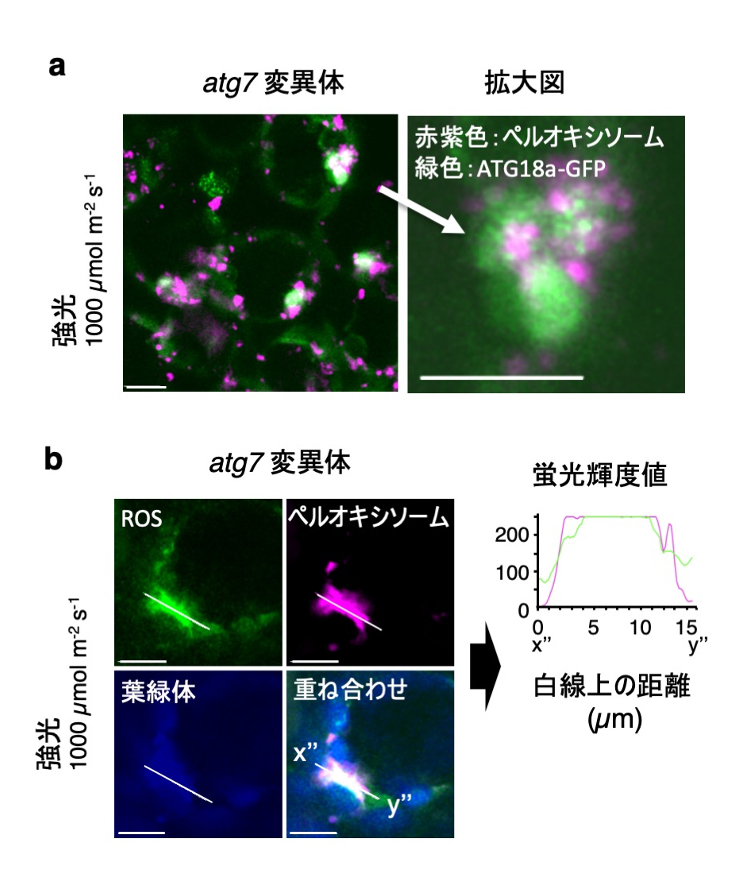 図4.
図4. 強光下で生じたペルオキシソームの巨大凝集体に集積するATG18a-GFPとペルオキシソーム内部に蓄積したROS
ペルオキシソームの凝集に集積するATG18a-GFP (a) およびROS (b)。スケールバー:10 µm
3. 液胞膜によるペルオキシソームの分解過程の解析
次に液胞膜を可視化して、強光下におけるペルオキシソームの分解過程を解析しました。液胞膜タンパク質Vam3と蛍光タンパク質Venusとの融合遺伝子を発現した植物の葉肉細胞を観察すると、野生株と変異体で生じたペルオキシソームの凝集体が、液胞膜で覆われている様子が確認されました(図5a)。大きさは、約150 µm
2ほどで、野生株よりも3−4倍の大きさでした(図5b)。この構造は変異体の葉肉細胞で多数見られました。
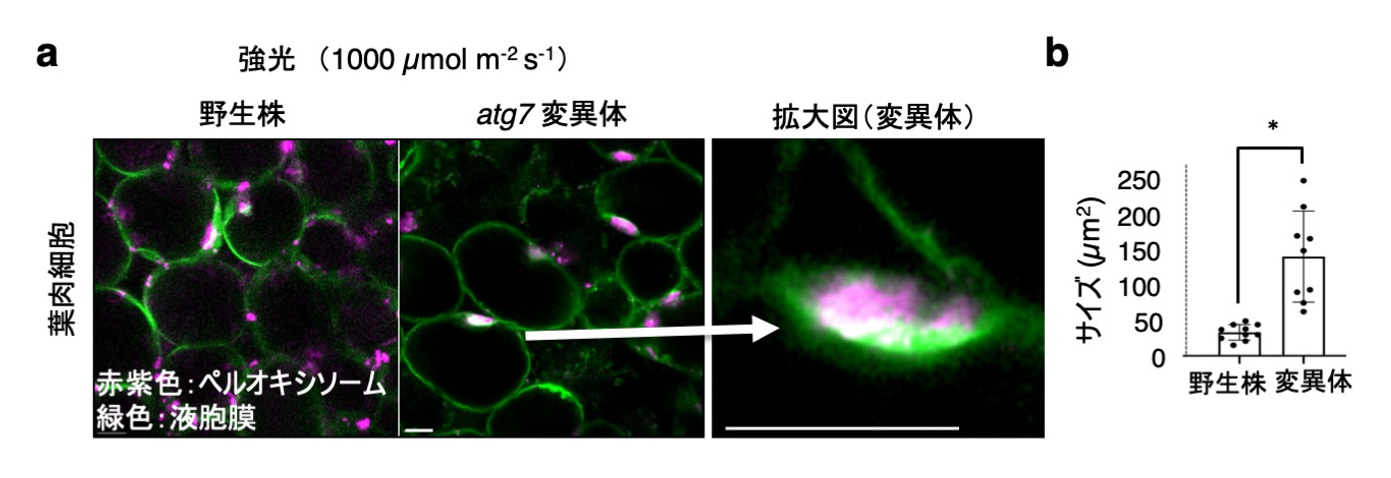 図5.
図5. 液胞に囲まれるペルオキシソームの凝集体
(a) 葉肉細胞内で液胞膜に囲まれるペルオキシソームの凝集体。白矢印は拡大像を示す。スケールバー:10 µm (b) ペルオキシソーム凝集体を囲む液胞膜構造の大きさの定量化。
さらに、この液胞を可視化した植物体から液胞を単離して解析すると、同様な構造が液胞の表層で鮮明に観察さられました(図6a)。変異体の液胞では、未分解の多くのペルオキシソームが液胞上に集積していました(図6b)。分解される過程のペルオキシソーム が液胞膜で覆われる構造は、酵母などで見られるオートファジーの過程で液胞膜が直接分解ペルオキシソームを包み込み液胞内部に取りこむ
ミクロペキソファジー(用語6)と同様な現象である可能性を示唆しました。
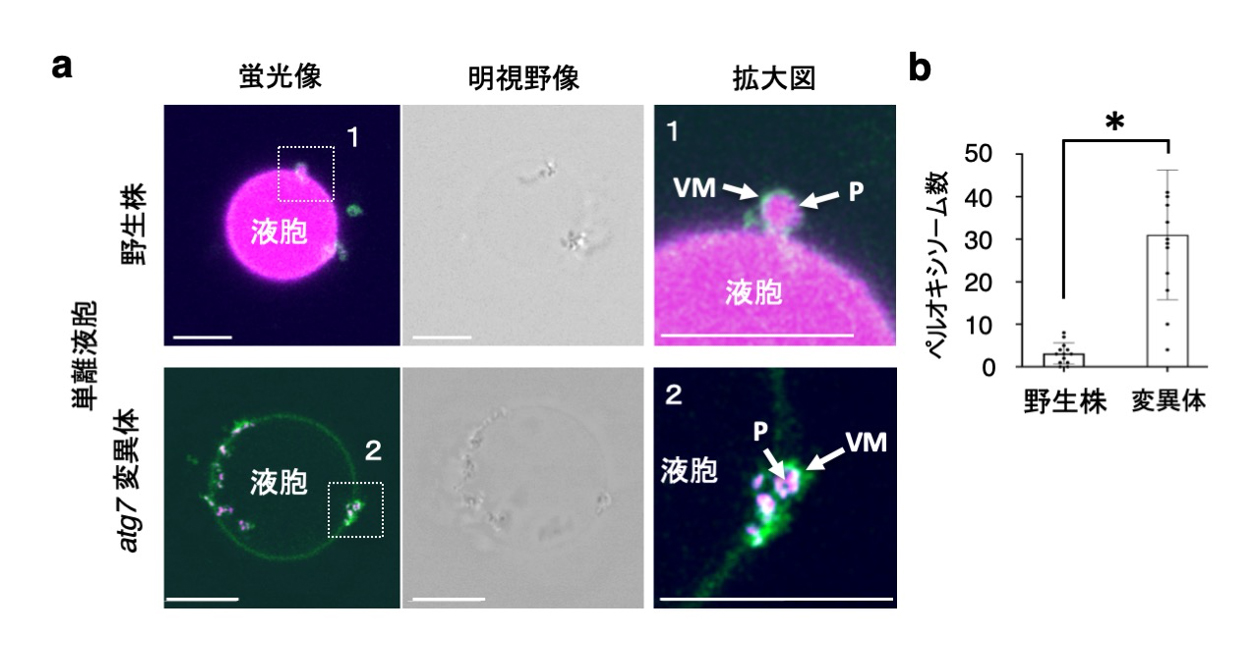 図6.
図6. 単離液胞の液胞膜に囲まれるペルオキシソームの凝集体
(a) 単離液胞上のペルオキシソーム(P)とGFPで可視化された液胞膜(VM)。拡大図(右)は、全体像(左)内の白破線の囲み内を示す。中央は全体像(左)の明視野像を示す。左図の(b) 単離液胞上に集積するペルオキシソームの数を定量化した。スケールバー:5 µm
4.
強光下におけるペルオキソーム分解機構
今回、強光下において、ATG18a-GFPで分解過程のペルオキシソームを可視化することや、それを包む液胞膜の構造を解析することで、ペキソファジーによるペルオキシソーム分解機構の解明が大きく進みました。強光下において、植物は、ROSの蓄積したペルオキシソームをペキソファジーにより優先的に分解することが明らかになりました。これは、強光下において、細胞内への過剰なROSの蓄積を防ぎ、健全なペルオキシソームを維持することで、効率的に光呼吸を行うために重要な植物細胞機能であると考えられます。これには、オートファゴソームの形成過程を介して液胞内へ輸送される
マクロペキソファジー(用語6)と、凝集体などの大きな構造を液胞膜により直接包み込んで液胞内へ輸送するミクロペキソファジーが同時に誘導されて、機能することが明らかとなりました。
【今後の展望】
今回、強光下でROSを蓄積したペルオキシソームを分解し、植物の強光ストレスを軽減するペキソファジーの役割が明らかになりました。しかし、ペルオキシソームの分解機構に関しては、まだ謎に包まれています。どのような因子(受容体など)がROSの蓄積したペルオキシソームを選択的に認識して、オートファジーを誘導しているのか明らかではありません。ペキソファジー分子機構をより明確に理解し、応用することで、環境ストレスに適応するより強い植物を産出されることが期待されます。
【用語解説】
(1)ペルオキシソーム:直径1 マイクロメートルほどの単膜系の細胞内小器官(オルガネラ)。植物では、脂肪性種子の発芽時における脂肪酸の分解や植物ホルモンの合成、緑葉での光呼吸など多くの代謝を担う。内部に、過酸化水素を分解するカタラーゼをもつ。
(2)オートファジー:オートファジーは細胞内部の自己成分を植物や酵母では液胞、動物ではリソソームで分解し再利用するシステム。ROSを蓄積したオルガネラや傷害を受けたオルガネラの選択的な分解も行う。
(3)活性酸素種(Reactive oxygen species, ROS):主に細胞内の代謝過程で生じる反応性(酸化力)の高い酸素種。スーパーオキシド、過酸化水素、ヒドロキシラジカル、一重項酸素等がある。DNA、タンパク質、細胞膜(脂質)等と反応し、オルガネラ等に損傷を与え、細胞機能に影響を与える。
(4)光呼吸:光合成にともない、リブロース1,5ビスリン酸カルボキシラーゼ/オキシゲナーゼ(RubisCO)のオキシゲナーゼ反応で生じたグリコール酸が順次、葉緑体、ペルオキシソーム 、ミトコンドリアを一巡して、CO
2等を生成して、葉緑体に戻る代謝経路(C2回路)。この経路では、過酸化水素も生成されるがペルオキシソーム内部のカタラーゼにより分解される。強光での光阻害を回避することに寄与していると考えられている。
(5)ペキソファジー:ペキソファジーは、オートファジーによる選択的オルガネラ分解機構の1つで、傷害を受けたペルオキシソームを特異的に分解する。
(6)マクロペキソファジーとミクロペキソファジー:両者は性質の異なるペキソファジーの機構である。マクロペキソファジーは、細胞質中において、分解されるペルオキシソームをペキソファゴソーム膜で包み込み隔離し、液胞まで輸送したのち、液胞内部に取り込み分解する。ミクロペクソファジーは、分解されるペルオキシソームを液胞膜がオートファジー因子と協調して直接的に包み込み液胞内部に取り込み分解する。
【論文情報】
掲載誌
:Nature Communications
掲載日
:2022年12月5日
論文名: Pexophagy suppresses ROS-induced damage in leaf cells under high-intensity light
(ペキソファジーは、強光下で生成された活性酸素種による葉の細胞傷害を抑制する)
著者名:Kazusato Oikawa, Shino Goto-Yamada, Yasuko Hayashi, Daisuke Takahashi, Yoshitaka Kimori, Michitaro Shibata, Kohki Yoshimoto, Atsushi Takemiya, Maki Kondo, Kazumi Hikino, Akira Kato, Keisuke Shimoda, Haruko Ueda, Matsuo Uemura, Keiji Numata, Yoshinori Ohsumi, Ikuko Hara-Nishimura, Shoji Mano, Kenji Yamada and Mikio Nishimura
DOI:
10.1038/s41467-022-35138-z
【研究支援】
本研究は、日本学術振興会(JSPS)科研費 及川和聡(JP17K07467)、真野昌二(JP26440157 and JP20570045)、西村幹夫(JP20370024、新学術領域JP22120007、Wyeth Foundation)、後藤(山田)志野(SONATA-BIS Grant:UMO-2019/34/E/NZ3/00299)、山田健志(TEAM/2017-4/41)、林八寿子(JP17K07467)、西村いくこ(JP15H05776、JP22000014、Wyeth Foundation、甲南学園平生太郎基金科学研究奨励助成金)、沼田圭司(ERATO JPMJER1602)の支援を受けました。
【内容に関するお問い合わせ】
ポーランド ヤギェウォ大学 マウォポルスカ研究所
植物分子生物学研究室
研究室長 山田 健志
E-mail: kenji.yamada@uj.edu.pl
基礎生物学研究所
名誉教授 西村 幹夫
(元甲南大学 平生太郎基金研究員)
E-mail: mramushini@gmail.com
【取材に関するお問い合わせ】
基礎生物学研究所 広報室
TEL:0564-55-7628
FAX : 0564-55-7597
E-mail: press@nibb.ac.jp





 図1. オートファジーによるペルオキシソーム分解機構の模式図
図1. オートファジーによるペルオキシソーム分解機構の模式図 図2. ATG18a-GFPによる分解ペルオキシソームの認識
図2. ATG18a-GFPによる分解ペルオキシソームの認識 図3. 強光ストレスで生じたペルオキシソームの巨大凝集体
図3. 強光ストレスで生じたペルオキシソームの巨大凝集体 図4. 強光下で生じたペルオキシソームの巨大凝集体に集積するATG18a-GFPとペルオキシソーム内部に蓄積したROS
図4. 強光下で生じたペルオキシソームの巨大凝集体に集積するATG18a-GFPとペルオキシソーム内部に蓄積したROS 図5. 液胞に囲まれるペルオキシソームの凝集体
図5. 液胞に囲まれるペルオキシソームの凝集体 図6. 単離液胞の液胞膜に囲まれるペルオキシソームの凝集体
図6. 単離液胞の液胞膜に囲まれるペルオキシソームの凝集体