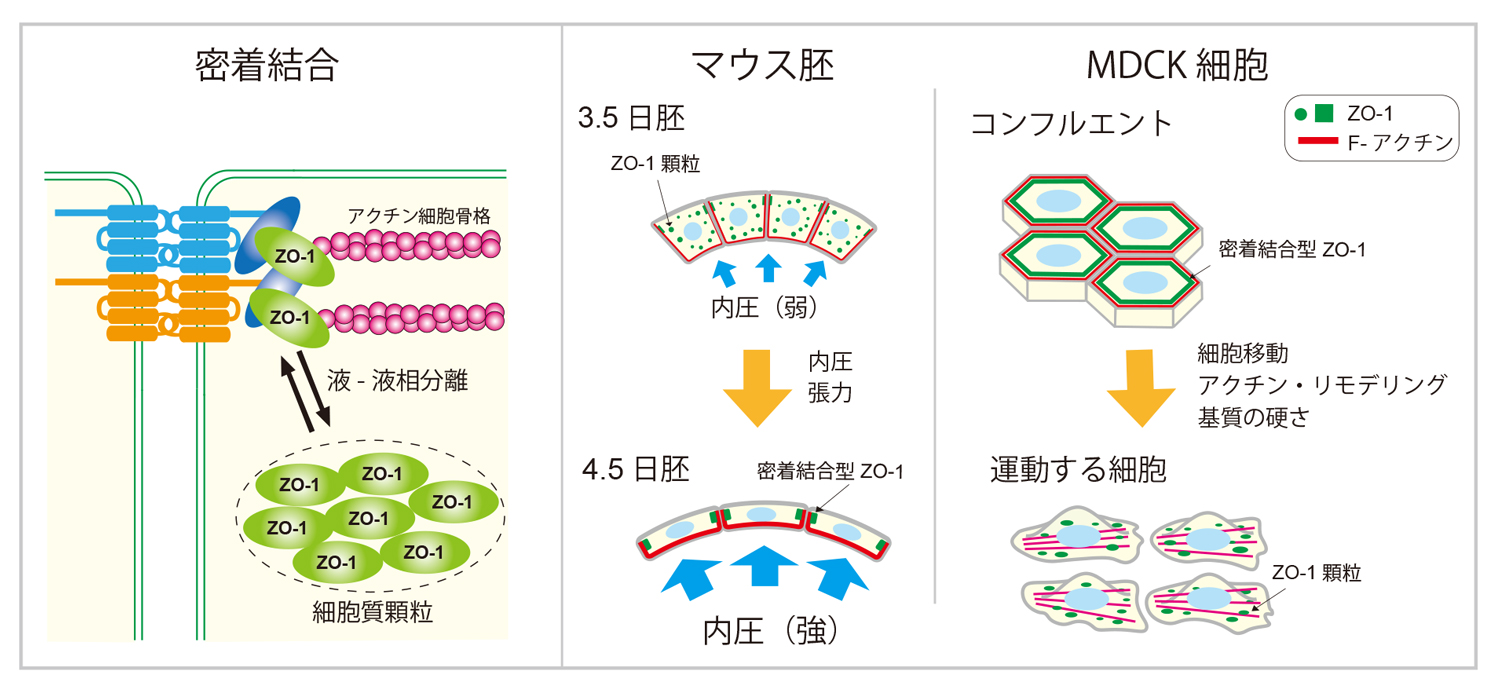
細胞と細胞の間をつなぐ密着結合は、生物の体や組織の表層にある上皮細胞同士の接着を担う構造の一つで、体や組織と外部環境を隔てる重要な役割をしています。密着結合は、細胞間接着に関わるクローディンなどの細胞膜タンパク質に、ZO-1をはじめとする細胞質タンパク質が細胞の内側で結合し、さらにアクチン細胞骨格が連結した構造体です。その中でZO-1は、細胞膜タンパク質とアクチン細胞骨格を結びつける重要な役割を担っています。基礎生物学研究所の木下典行准教授、上野直人教授、藤森俊彦教授らは、マウス胚と動物培養細胞(MDCK細胞とA6細胞)を用い、ZO-1が細胞質内で顆粒を形成し、密着結合部位との間で局在を変化させることにより、密着結合の形成と細胞間接着の強度を制御していることを発見しました。さらに、このZO-1の細胞質顆粒が液-液相分離により形成されること、その制御に細胞の力学的な環境が関わっていることを明らかにしました。本研究成果は、iScience誌に掲載されました。
【研究の背景】
生物の細胞や組織は、さまざまな物理的力を受けています。近年、多くの細胞が、このような力学的刺激を感知し、それに対して応答する仕組みを持っていることがわかってきました。本研究グループでは、アフリカツメガエル原腸胚に対して人為的なストレッチ(伸展)刺激を加えることにより、一群のプロテイン・キナーゼが活性化され、細胞間接着関連タンパク質など、さまざまなタンパク質がリン酸化されることを見つけました。そしてこの力学刺激によって、上皮細胞のZO-1が細胞質顆粒から密着結合部位へ蓄積され、その結果として密着結合が強化されることを明らかにしました。この仕組みは、アフリカツメガエルの胚の発生でも、原腸形成期の外胚葉の伸展の過程で、胚の頑強性を増加させる仕組みとして機能していました(Hashimoto et al., Cell Systems 8, 226-241 (2019)、Kinoshita et al., Cell Reports 30, 3875-3888 (2020))。しかし、このようなZO-1の局在変化による細胞間接着調節の仕組みが、アフリカツメガエル胚以外にも広く存在するのか、そしてZO-1の細胞質顆粒がどのような仕組みで作られ、密着結合部位との間の局在変化がどのように制御されているかは未解明でした。
【研究の成果】
ZO-1の細胞質顆粒から密着結合への局在変化がマウス胚でも起きるかどうかを、受精後3.5日(E3.5)から4.5日(E4.5)の間で起きる孵化の過程に注目して観察しました。孵化は、透明帯に包まれた胚が、液で満たされた胞胚腔の内圧上昇により膨張して透明帯の外に出ることで起こります(図1)。この過程で顕著に伸展する栄養外胚葉細胞のZO-1を観察すると、孵化前は細胞質顆粒が多く観察されますが、孵化の過程でそれらがほとんど消失して密着結合に蓄積していることがわかりました。また、Rhoキナーゼ(ROCK)阻害剤を用いた細胞表層の張力の低下や、胞胚腔の内圧上昇を阻害することにより、ZO-1の密着結合への蓄積が阻害されました。これらのことから、ZO-1が力学的な刺激によりその局在を変化させていること、その結果として胚の細胞間接着を強化していることがわかりました。
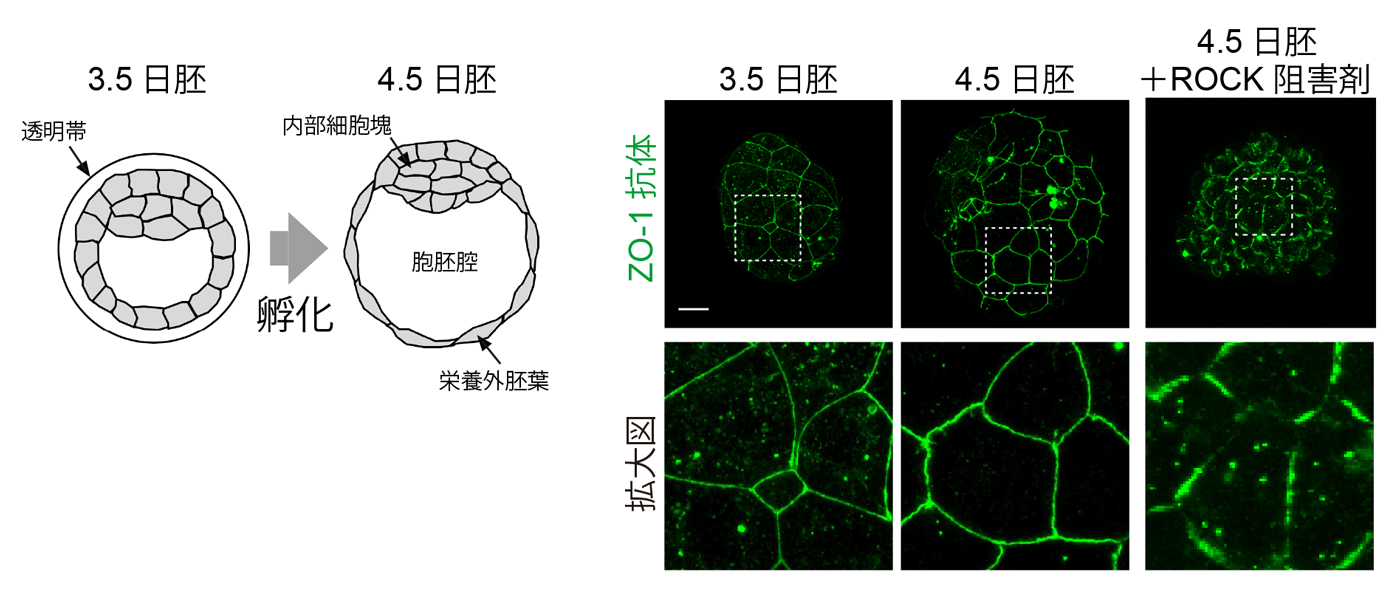
図1 孵化前と孵化後のマウス胚を用いたZO-1の免疫染色。孵化前(3.5日胚)には細胞質顆粒が多く見られ、孵化後(4.5日胚)ではそれらが消失して密着結合部位に蓄積した。
ここで観察されたZO-1の細胞質顆粒が液-液相分離により形成されている可能性を考え、さらに研究を進めました。液-液相分離は、分子間相互作用などによって、均一に混ざった混合系から液滴の性質をもつ凝集体を形成する過程です。特定のタンパク質を高濃度に含むこの凝集体は、他のオルガネラのように膜に包まれていないことから非膜オルガネラとも呼ばれます。まず、液-液相分離により形成される凝集体を乖離させることが知られている1,6-ヘキサンジオールで、孵化前のマウス3.5日胚を処理すると、ZO-1の細胞質顆粒が数分で消失しました。このことからZO-1の細胞質顆粒は液-液相分離により形成されることがわかりました。
イヌ腎臓由来の培養細胞であるMDCK細胞においても、細胞同士が密着して強く接着している状態ではZO-1は密着結合に局在しますが、創傷治癒アッセイで細胞が動き始める時や細胞接着を弱めた時、細胞の足場である基質の硬さを低めた時など、物理環境が変化したときに、ZO-1は密着結合から離れ、細胞質顆粒を形成しました(図2A)。そして、これらの条件で見られる細胞質顆粒も液-液相分離によって形成されていることが確かめられました。
さらにこの液-液相分離による顆粒形成が、アクチン線維との相互作用により負の制御を受けていることもわかりました。アフリカツメガエル腎臓由来のA6細胞を用いた実験系では、アクチン結合領域を欠損したZO-1(ZO-1ΔABD)は密着結合に局在せず、細胞質顆粒を形成しました(図2B)。さらに、アクチン細胞骨格を破壊するlatrunculin B処理によっても、液-液相分離による細胞質顆粒が形成されることを明らかにしました(図3(動画))。また、天然変性領域(IDR)を欠損させたZO-1(ZO-1ΔIDR)は顆粒を形成せず、細胞質に均一に局在することから(図2B)、この領域が液-液相分離に必須の領域であることがわかりました。アクチン結合領域は天然変性領域の中に存在しています。これらの結果から、アクチン線維のZO-1への結合が、天然変性領域によって誘導された液-液相分離状態を解消する負の制御機構の存在が明らかとなりました。
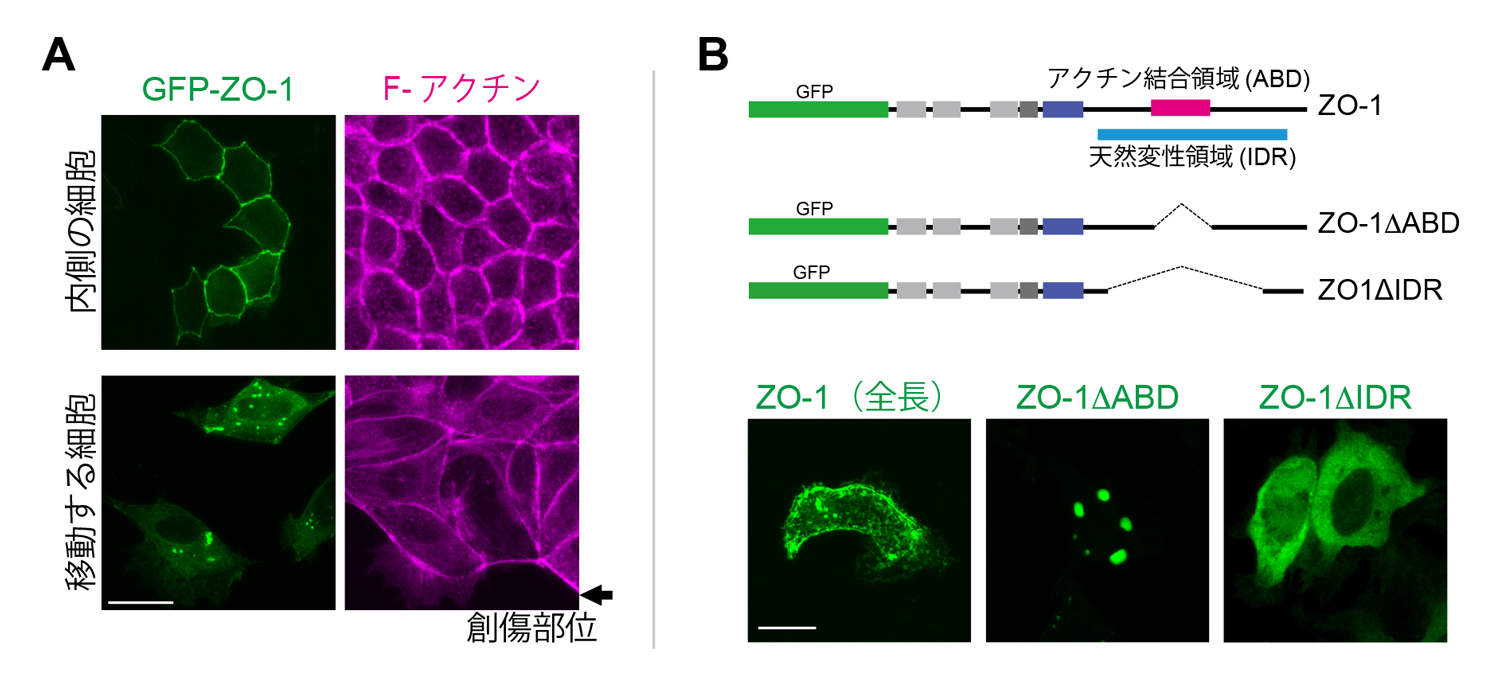
図2 培養細胞を用いたZO-1局在のダイナミクス。(A) 創傷治癒アッセイにおけるZO-1の局在変化。創傷部位から離れた内側の細胞ではZO-1は密着結合部位に局在し、創傷部位近傍の移動している細胞では、液-液相分離による細胞質顆粒が形成された(MDCK細胞)。(B) F-アクチン結合によるZO-1の液-液相分離の制御。全長ZO-1は細胞表層にあるが、アクチン結合領域(ABD)を欠損すると、細胞質顆粒を形成する。天然変性領域を欠失させると、細胞質に均一に局在した(アフリカツメガエルA6細胞)。
図3(動画)GFP-ZO-1を発現しているA6細胞を、アクチン重合阻害剤Latrunculin B処理した。”+LatB”が表示される8分から25分まで薬剤処理し、その後洗浄して薬剤を除去した。
本研究では、ZO-1タンパク質が、液-液相分離により、密着結合部位と細胞質顆粒の間をダイナミックかつ可逆的に局在を変化させること、その制御に、細胞・組織の力学的な環境が関与していることを明らかにしました。液-液相分離によって作られた凝集体内の分子は、細胞質の分子と平衡を保ちながら液性の動的な性質を保持しています。このような凝集体を形成することにより、外部からの力学刺激など外部環境の変化を感知した細胞が、細胞間接着の強度の調節を素早く行い、組織の安定性を維持することを可能にしていると考えられます。
【今後の展望】
「私たちは、ZO-1が力学刺激に反応して局在を変化させることを発見しました。しかし、細胞がどのように力学刺激を受け取り、それをZO-1分子に伝えているか、その分子機構はまだ明らかではありません。私たちの研究グループでは、力学刺激により一群のプロテインキナーゼが活性化すること、細胞接着関連タンパク質のリン酸化が上昇することを報告しています。ZO-1の液-液相分離が、このようなタンパク質リン酸化により制御されている可能性も考え、その分子機構の解明を行なっていきたいと考えています。
上皮細胞の強固な細胞間接着が弱められ、細胞移動が可能になる現象は、上皮-間充織転換と呼ばれています。私たちは、創傷治癒アッセイなどの上皮-間充織転換の実験系において、ZO-1が液-液相分離によって細胞質顆粒を形成することを発見しました。この上皮-間葉転換の現象は、がん細胞が転移する際にも起こることが知られていることから、ZO-1のダイナミクスが、転移における細胞移動の背景になっていると考えられます。
液-液相分離はアルツハイマー病をはじめとする神経変性疾患にも関わっていることが知られており、液-液相分離の制御機構の解明は重要課題の一つです。本研究では、ZO-1の天然変性領域とアクチン線維の相互作用が、ZO-1の液-液相分離を制御していることを示しました。このような液-液相分離のコントロールの仕組みを明らかにすることは、疾患のメカニズムに対する理解を深めることに繋がるかもしれません。」
【発表雑誌】
雑誌名 iScience
掲載日 2022年2月18日
論文タイトル: Force-dependent remodeling of cytoplasmic ZO-1 condensates contributes to cell-cell adhesion through enhancing tight junctions
著者: Noriyuki Kinoshita, Takamasa S. Yamamoto, Naoko Yasue, Chiyo Takagi, Toshihiko Fujimori, Naoto Ueno
DOI: https://doi.org/10.1016/j.isci.2022.103846
【研究チーム】
本研究は基礎生物学研究所 形態形成研究部門と初期発生研究部門の共同研究チームにより実施されました。
【研究サポート】
本研究は本研究は科学研究費助成事業(20K06663, 17H03689, 16H06280, 22127007, 15H05865, 21H02493)のサポートを受けて実施されました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 形態形成研究部門
教授 上野直人
TEL: 0564-55-7570
E-mail: nueno@nibb.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp






 図1 孵化前と孵化後のマウス胚を用いたZO-1の免疫染色。孵化前(3.5日胚)には細胞質顆粒が多く見られ、孵化後(4.5日胚)ではそれらが消失して密着結合部位に蓄積した。
図1 孵化前と孵化後のマウス胚を用いたZO-1の免疫染色。孵化前(3.5日胚)には細胞質顆粒が多く見られ、孵化後(4.5日胚)ではそれらが消失して密着結合部位に蓄積した。 図2 培養細胞を用いたZO-1局在のダイナミクス。(A) 創傷治癒アッセイにおけるZO-1の局在変化。創傷部位から離れた内側の細胞ではZO-1は密着結合部位に局在し、創傷部位近傍の移動している細胞では、液-液相分離による細胞質顆粒が形成された(MDCK細胞)。(B) F-アクチン結合によるZO-1の液-液相分離の制御。全長ZO-1は細胞表層にあるが、アクチン結合領域(ABD)を欠損すると、細胞質顆粒を形成する。天然変性領域を欠失させると、細胞質に均一に局在した(アフリカツメガエルA6細胞)。
図2 培養細胞を用いたZO-1局在のダイナミクス。(A) 創傷治癒アッセイにおけるZO-1の局在変化。創傷部位から離れた内側の細胞ではZO-1は密着結合部位に局在し、創傷部位近傍の移動している細胞では、液-液相分離による細胞質顆粒が形成された(MDCK細胞)。(B) F-アクチン結合によるZO-1の液-液相分離の制御。全長ZO-1は細胞表層にあるが、アクチン結合領域(ABD)を欠損すると、細胞質顆粒を形成する。天然変性領域を欠失させると、細胞質に均一に局在した(アフリカツメガエルA6細胞)。