
基礎生物学研究所




2017.08.01
理化学研究所
自然科学研究機構 基礎生物学研究所
理化学研究所(理研)眞貝細胞記憶研究室の眞貝洋一主任研究員、白井温子研究員と自然科学研究機構基礎生物学研究所の中山潤一教授、川口隆之研究員らの共同研究グループ※は、哺乳類において、ノンコーディングRNA[1]が高次クロマチン形成に重要な役割を果たすことを発見しました。
ヘテロクロマチン[2]は、染色体機能の維持、発生や疾患におけるエピジェネティック[3]な遺伝子発現抑制など、さまざまな生命現象に重要な役割を果たす代表的な高次クロマチン構造です。ヘテロクロマチンの形成や機能の維持に中心的な役割を果たすヒストン[4]メチル化酵素Suv39h1[5]のノックアウトマウス[6]では染色体異常が誘導され、多くは致死になることからも、その重要性が認識されていました。一方、酵母やショウジョウバエなどでは、ヘテロクロマチン構造の形成にRNA干渉[7]が関与することが明らかになっていましたが、高等真核生物ではRNAがヘテロクロマチン形成に関与するかを含めて、その形成の仕組みの詳細は分かっていませんでした。
今回、共同研究グループは、ヘテロクロマチン領域で転写されるノンコーディングRNAがSuv39h1のクロマチン結合に重要な役割を果たすことを発見しました。ヘテロクロマチン領域では、Suv39h1によってヒストンH3K9がトリメチル化されたH3K9me3が蓄積しており、このH3K9me3が逆にSuv39h1のクロマチン結合に必須であることが知られていました。本研究において、まずSuv39h1が単独でRNAと結合できること、またRNAに結合できない変異Suv39h1を発現させると、ヘテロクロマチン形成に異常がみられ、ヘテロクロマチン領域へのSuv39h1自身の蓄積が低下することが明らかになりました。これらの結果は、哺乳類でも、ノンコーディングRNAがSuv39h1によるヘテロクロマチン形成に重要な役割を果たすことを示しています。
本研究では、ノンコーディングRNAに依存したSuv39h1によるヘテロクロマチン形成機構が高等真核生物まで保存されていることが明らかになりました。進化的に保存された本機構は、先天性疾患を引き起こす染色体不安定性の原因を解明するのに重要な一歩になると期待できます。
本研究は、オンライン科学雑誌『eLife』(8月1日付け)に掲載されます。
※共同研究グループ
理化学研究所 眞貝細胞記憶研究室
主任研究員 眞貝 洋一 (しんかい よういち)
研究員 白井 温子 (しらい あつこ)
自然科学研究機構 基礎生物学研究所 クロマチン制御研究部門
教授 中山 潤一 (なかやま じゅんいち)
研究員 川口 隆之 (かわぐち たかゆき)
東京工業大学 科学技術創成研究院
教授 木村 宏 (きむら ひろし)
横浜市立大学 大学院生命医科学研究科
特別契約教授 西村 善文 (にしむら よしふみ)
1.背景
全ての真核生物は、クロマチンと呼ばれるDNA、タンパク質、RNAから構成される複合体を持っています。特に、高度に凝縮したクロマチン構造であるヘテロクロマチンは、染色体機能の維持、発生や疾患におけるエピジェネティックな遺伝子発現抑制など、さまざまな生命現象に重要な役割を果たす代表的な高次クロマチン構造です。
哺乳類の染色体では、動原体(セントロメア)近傍のペリセントロメア[8]は、メジャーサテライトと呼ばれる配列が1万回近くも繰り返して並んだ配列から構成され、その領域に典型的なヘテロクロマチン(ペリセントロメアヘテロクロマチン)が存在しています(図1)。特に、ヘテロクロマチン領域では翻訳後修飾の一つであるヒストンH3の9番目のリジン残基がトリメチル化されたH3K9me3が特徴的に蓄積していることが知られています。ペリセントロメアヘテロクロマチンは、ヒストンメチル化酵素のSuv39h1がH3K9のトリメチル化を触媒し、そのメチル化修飾部位をヘテロクロマチン構造タンパク質であるHP1が認識・結合することにより形成されることが知られています(図2)。
一方、ショウジョウバエや分裂酵母などのモデル生物では、RNA干渉がヘテロクロマチン形成に関与することが知られています。しかし哺乳類では、RNA干渉もしくは他のRNAを介した機構が、ヘテロクロマチン形成や維持に関与しているかは分かっていませんでした。
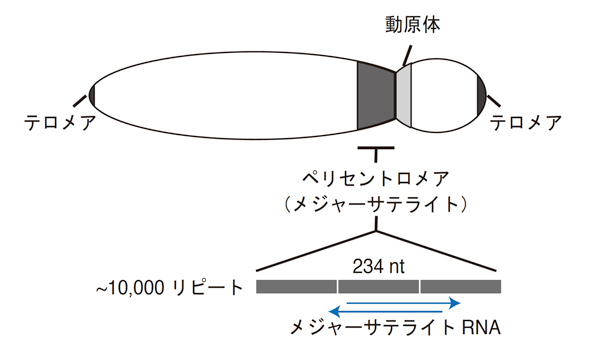
図1 ペリセントロメアの模式図
マウスのペリセントロメアは、動原体(セントロメア)の近傍に存在している。ペリセントロメアは、234塩基から成るメジャーサテライトと呼ばれる配列が、10,000回近くも繰り返して並んだ配列から構成される領域。この領域には典型的なヘテロクロマチン(ペリセントロメアヘテロクロマチン)が存在している。また、近年、メジャーサテライトDNA領域からRNAが転写されていることが明らかになった。
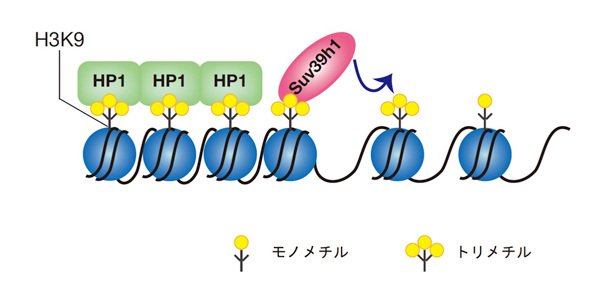
図2 哺乳類のヘテロクロマチン形成
哺乳類のペリセントロメアヘテロクロマチンは、ヒストンメチル化酵素であるSuv39h1がヒストンH3K9をトリメチル化し、そのメチル化修飾部分にヘテロクロマチン構造タンパク質であるHP1が結合することにより、ヘテロクロマチンが形成される。
2.研究手法と成果
ヘテロクロマチン構造の形成に関わる因子は進化的によく保存されており、分裂酵母には、Clr4[5]と呼ばれるマウスのヒストンメチル化酵素Suv39h1の相同因子があります。共同研究グループは以前に分裂酵母のClr4を用いた解析から、Clr4がメチル化ヒストンの結合に関わるクロモドメイン[9](CD)を介してRNAにも結合できることを見いだしました注1)。そこで共同研究グループは、Suv39h1もCDを介してRNAに結合できるのではないかと考え、マウスの細胞を用いて実験を行いました。
まず、Suv39h1とRNAとの結合を生化学的に調べたところ、Suv39h1のCDはRNAと結合し、ヒストンのメチル化の程度に影響されないことを発見しました。次に、Suv39h1がRNAだけでなくDNAとも結合するのか生化学的に解析したところ、Suv39h1のCDはDNAとも結合するが、その結合はRNAとの結合より弱いことが分かりました。
Suv39h1のCDはRNAと結合できることが分かりましたが、CDはH3K9me3とも結合できます。そこで、H3K9me3と結合するSuv39h1のCDを解析し、その結合に関わるアミノ酸残基を同定しました。そして、生化学的な解析により、両者の結合は独立していることを見いだしました。これらの結果は、Suv39h1がCDを介して、H3K9me3とRNAの両方に結合でき、両者の結合はそれぞれ独立に機能していることを示しています。さらに、細胞内においても、Suv39h1はCDのRNA結合活性依存的に、ペリセントロメア領域から転写された「メジャーサテライトRNA[10]」と結合していることが分かりました。
次に、実際に細胞内でのSuv39h1のRNA結合がヘテロクロマチン形成にどのような役割を果たしているかを、ペリセントロメア領域のH3K9me3が消失するSuv39h欠損iMEF細胞[11]に、変異型のSuv39h1を導入して機能解析を行いました。その結果、H3K9me3結合部位に変異を導入した細胞だけでなく、RNA結合部位に変異を導入した細胞でもヘテロクロマチン形成が遅れることが分かりました。また、これらの細胞株における核の状態を顕微鏡で観察したところ、Suv39h1のH3K9me3結合部位とRNA結合部位に変異を導入した細胞では、ヘテロクロマチン領域にSuv39h1が蓄積している細胞の割合が低下していました。
これらの結果は、変異型のSuv39h1が安定的にヘテロクロマチン領域につなぎ止められていないからだと考え、Suv39h1の動的な挙動を顕微鏡で観察しました。すると、H3K9me3結合部位に変異を導入した細胞だけでなく、RNA結合部位に変異を導入した細胞も、ヘテロクロマチン領域でのSuv39h1の動きが速くなっていること、つまり可動性が増していることが分かりました(図3)。しかし、これだけではメジャーサテライトから転写されているメジャーサテライトRNAがSuv39h1の動きに影響を与えている直接的な結果にはなりません。そこで、核内のメジャーサテライトRNAをノックダウンした細胞で、Suv39h1の挙動を顕微鏡で観察したところ、ノックダウンすることでもSuv39h1の動きが速くなることを明らかにしました。
以上の結果から、共同研究グループは、Suv39h1が安定的にクロマチンに結合するためにメジャーサテライトRNAが重要な役割を果たし、それがヘテロクロマチン形成に重要であるということを明らかにしました(図4)。
注1) Ishida et.al. Molecular Cell, 47, 228-241 (2012)
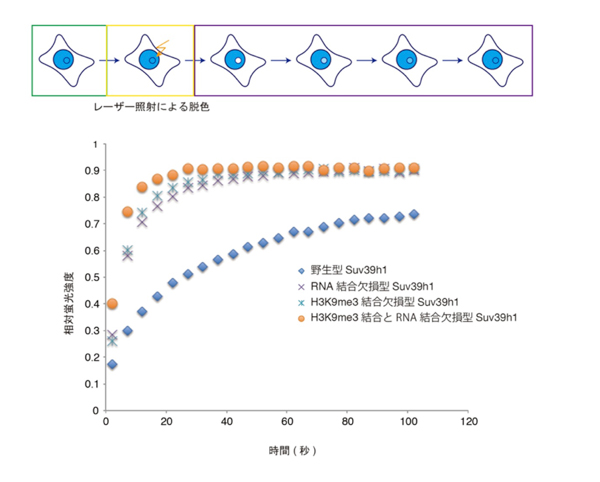
図3 RNA結合欠損型Suv39h1やH3K9me3結合欠損型Suv39h1の動的挙動
細胞の核中の一部分に強いレーザーを照射して蛍光を退色させた後、その領域に戻ってくる蛍光タンパク質を測定し解析した。その結果、RNA結合欠損型Suv39h1もH3K9me3結合欠損型Suv39h1も、戻ってくる蛍光タンパク質の動きが野生型に比べて速くなり、可動性が増していることが分かった。
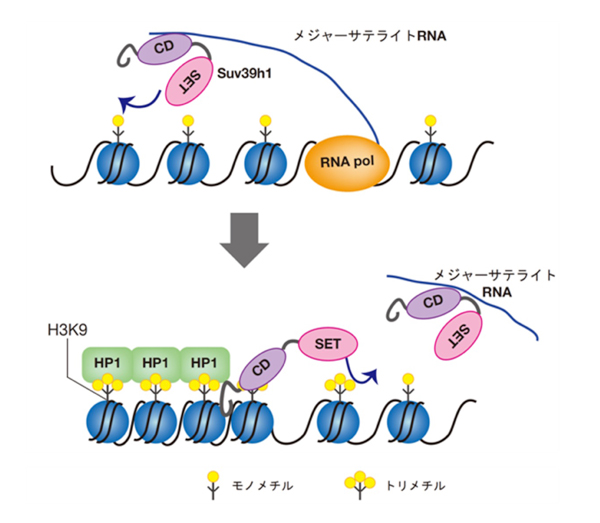
図4 RNAが媒介する哺乳類のヘテロクロマチン形成機構
クロモドメイン(CD)とSETドメイン(SET)を持つSuv39h1は、メジャーサテライト RNAとCDを介して結合し、またH3K9me3と結合することで、効率的にヘテロクロマチン領域のヒストンH3K9をトリメチル化し、ヘテロクロマチンを形成するという新しい機構が示された。
3.今後の期待
共同研究グループは、酵母から哺乳類に至るまで進化的に保存されたSuv39h1を介したヘテロクロマチン形成において、RNAへの結合が重要な役割を持つことを明らかにしました。近年、染色体異常が原因の先天性疾患が報告されていますが、その仕組みを完全に理解するには至っていません。
本研究で広く保存されたRNAを介した機構を明らかにしたことより、未だに明らかにされていない初期のヘテロクロマチン形成を解明する糸口となり、先天性異常を引き起こす染色体不安定性を解明する重要な一歩になると期待できます。
4.論文情報
<タイトル>
Impact of nucleic acid and methylated H3K9 binding activities of Suv39h1 on its heterochromatin assembly
<著者名>
Atsuko Shirai, Takayuki Kawaguchi, Hideaki Shimojo, Daisuke Muramatsu, Mayumi, Ishida-Yonetani, Yoshifumi Nishimura, Hiroshi Kimura, Jun-ichi Nakayama and Yoichi Shinkai
<雑誌>
eLife
<DOI> https://doi.org/10.7554/eLife.25317
5.補足説明
[1] ノンコーディングRNA
タンパク質をコードしないRNA。
[2] ヘテロクロマチン
クロマチン(DNA、RNA、タンパク質からなる核内の構造体)のうち、転写が不活性で常に凝縮した状態にある領域のこと。近年、ヘテロクロマチン領域からも転写が起こっていることが分かっている。
[3] エピジェネティック
遺伝情報を伝達するゲノムDNAの塩基配列自体には変更を加えずに、DNA塩基やクロマチンを構成するタンパク質の化学修飾などを介して、ゲノムDNAの機能を調節する分子機構のことをエピジェネティクスという。エピジェネティックはエピジェネティクスの形容詞形。
[4] ヒストン
真核生物のクロマチン(染色体)を構成する主要なタンパク質で、長大なDNAを収納する際に必要となる。ヒストンH2A、H2B、H3、H4が2分子ずつ集まったヒストン8量体にDNA約148 bpが巻きつくことで核内に機能的に収納できるようになる。
[5] Suv39h1、Clr4
ヒストンH3の9番目のリジン残基をメチル化修飾する酵素。主にヘテロクロマチン近傍に位置し、メチル化修飾を介してヘテロクロマチン形成に寄与する。マウスSuv39h1に相同なタンパク質が分裂酵母のClr4である。
[6] ノックアウトマウス
遺伝子操作により、ゲノム上のある特定の遺伝子や塩基配列を欠損させたマウスのこと。
[7] RNA干渉
細胞内に導入された短い2本鎖RNAによって、それと相補的な塩基配列を持つmRNAが特異的に分解される現象。線虫からヒトに至るまで、進化的によく保存された機構。分裂酵母ではRNA干渉に関わる代表的なタンパク質は保存されているが、mRNAの分解のような細胞質でおこる現象には関わらず、核内のヘテロクロマチン形成にRNA干渉が関与することが知られている。
[8] ペリセントロメア
セントロメア(動原体)と隣接するクロマチン領域。マウスでは234 塩基からなるメジャーサテライトと呼ばれる配列が1万回近くも繰り返されており、ヘテロクロマチン化されている。
[9] クロモドメイン
クロマチンの構造変化に関わるタンパク質に見いだされる、進化的によく保存された領域。メチル化されたヒストンに高親和性を示すことが知られている。
[10] メジャーサテライトRNA
ペリセントロメア領域から転写されるメジャーサテライト配列のノンコーディングRNA。
[11] Suv39h欠損iMEF細胞
Suv39h1とSuv39h2を欠損したマウス胎児由来線維芽(MEF)細胞。Suv39h欠損細胞では、ペリセントロメア領域のH3K9me3が消失することが知られている。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせ下さい
理化学研究所 眞貝細胞記憶研究室
主任研究員 眞貝 洋一(しんかい よういち)
研究員 白井 温子(しらい あつこ)
TEL:048-467-9370(白井) FAX:048-462-4670 E-mail:ashirai@riken.jp(白井)
自然科学研究機構基礎生物学研究所 クロマチン制御研究部門
教授 中山 潤一 (なかやま じゅんいち)
研究員 川口 隆之 (かわぐち たかゆき)
TEL:0564-55-7680(中山) FAX:0564-55-7684
E-mail:jnakayam@nibb.ac.jp(中山)
<機関窓口>
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press@riken.jp