
基礎生物学研究所




2016.07.27
体液(細胞外液)の塩濃度を一定に保つことは動物の生存にとって必須です(体液恒常性)。体液のナトリウム(Na+)と水のバランスが崩れた時、例えば、脱水(水欠乏)状態に陥ると、体液中のNa+濃度と浸透圧が上昇します。この時、私たちは水分摂取を行うとともに塩分摂取を抑制します。基礎生物学研究所・統合神経生物学研究部門の研究グループはこれまでに、脳弓下器官及び終板脈管器官のグリア細胞に発現するNaチャンネル分子、Naxが塩分摂取行動制御を担うNa+濃度センサーであることを明らかにしていました。一方、水分摂取行動制御を担うセンサー分子は不明でした。今回、作田拓助教と野田昌晴教授らは、遺伝子欠損マウスを用いた実験から、Naxの情報が水分摂取行動制御も担っていること、さらに、その情報伝達の仕組みを明らかにしました。さらにこの研究から未知の浸透圧センサー分子の存在も示唆されました。
本研究成果は、2016年8月1日に米生理学会誌 American Journal of Physiology - Regulatory, Integrative and Comparative Physiologyに掲載されます。
【背景】
体液(血液や脳脊髄液等の細胞外液)の浸透圧を一定に保つことは生命を維持するために必須であり、そのため体液中のNa+濃度は一定に保たれている(体液恒常性)。そのため、ヒトを含む動物は体液のナトリウム(Na+)濃度と浸透圧を常時モニターする仕組みを獲得したと考えられています。体液のNa+と水のバランスが崩れた時、例えば、長時間の脱水は体液中のNa+濃度と浸透圧を上昇させます。この時私たちは、のどの渇きを覚え、ただちに水分摂取を行うとともに塩分摂取を抑制します。体液中のNa+濃度や浸透圧の変動は、脳内の感覚性脳室周囲器官(脳弓下器官や終板脈管器官)と呼ばれる領域において、それぞれ独立にモニターされていると考えられています。ここではNa+濃度や浸透圧のセンサーをはじめ、体液成分のモニタリングに関わる分子が特異的に発現し、体液恒常性制御の根幹を担っていると考えられていますが、その実体は長らく不明のままでした。研究グループは、脳弓下器官及び終板脈管器官のグリア細胞に特異的に発現するNaチャンネル分子、NaxがNa+濃度センサーであり、その情報が塩分摂取行動制御を担っていることを一連の研究を通して明らかにしてきました。一方、Naxが飲水行動制御に関与するかについては不明でした。また浸透圧センサーに関しては、TRPチャンネルファミリー分子であるTRPV1とTRPV4がその候補分子として報告されていましたが、異なる研究グループ間で実験結果が一致せず、未だ結論に至っていませんでした。
【本研究の成果】
研究グループは、脳内のセンサー分子を直接刺激するために、高濃度の塩化ナトリウム溶液やソルビトール溶液を脳室内へ注入する実験方法をとり、Nax 、TRPV1、およびTRPV4の遺伝子欠損マウスを用いてその行動解析を行いました。高濃度の塩化ナトリウム溶液を脳室内へ注入すると脳脊髄液中のNa+濃度と浸透圧の両方が上昇しますが、高濃度のソルビトール溶液を脳室内へ注入すると浸透圧のみが上昇します。高濃度のソルビトール溶液を脳室内へ注入して、純粋に浸透圧のみを上昇させたところ、どの遺伝子欠損マウスも野生型マウスと同程度の水分を摂取しました(図1;Sorbitol)。このことから、TRPV1とTRPV4は浸透圧センサーとして水分摂取行動の誘発に関与していないこと、さらに本研究で検討した分子以外の未知の浸透圧センサーが存在していることが示唆されました。
次に高濃度の塩化ナトリウム溶液を脳室内へ注入したところ、Nax 欠損マウスとTRPV4欠損マウスにおいて、水分摂取が野生型マウスやTRPV1欠損マウスに比べ半分程度であることから、この2つの分子が体液Na+濃度上昇よる水分摂取誘発に関与していることがわかりました(図1;NaCl)。またNax /TRPV4二重欠損マウスの水分摂取量は、それぞれの遺伝子欠損マウスと同程度だったことから、Nax とTRPV4は同じ情報伝達経路を共有していることが推測されました。
TRPV4は内因性リガンドであるのエポキシエイコサトリエン酸によって活性化されること、またグリア細胞がのエポキシエイコサトリエン酸を放出することが報告されており、Na+濃度上昇に応答したNaxを発現するグリア細胞からエポキシエイコサトリエン酸が放出され、これによってTRPV4が活性化されるという可能性が考えられました。そこでエポキシエイコサトリエン酸の合成阻害剤であるミコナゾールの塩化ナトリウム溶液注入時の水分摂取に対する影響を調べました。ミコナゾールは、野生型マウスの水分摂取量をNax欠損マウスやTRPV4欠損マウスと同程度まで減少させましたが、Nax欠損マウスとTRPV4欠損マウスの水分摂取をさらに減少させることはありませんでした(図2A)。逆にエポキシエイコサトリエン酸やその前駆体であるアラキドン酸は、Nax欠損マウスの水分摂取量を野生型マウスレベルまで回復させましたが、TRPV4欠損マウスの水分摂取を回復させることはありませんでした(図2B)。これらの結果は、Naxが水分摂取行動制御を担うNa+濃度センサーであり、その情報はエポキシエイコサトリエン酸を介して下流のTRPV4へと伝えられることを示しています。TRPV4がグリア細胞ではなく神経細胞に発現していることが判明したことから、研究グループは、図3のような水分摂取行動惹起のシグナル伝達機構のモデルを提唱しました。
【本研究の意義と今後の展開】
動物が脱水状態に陥ると、体液恒常性を維持するために、水分摂取を促進し、塩分摂取を抑制します。本研究によって、Na+濃度センサーNaxが、これまで明らかにしてきた塩分摂取制御ばかりではなく、水分摂取制御をも担う分子であることが明らかになりました。これは、体液恒常性維持機構の理解を一歩前進させる成果です。体液恒常性の異常は重篤な全身状態の悪化をもたらすことが知られています。また、体液恒常性維持機構と血圧調節機構の間には従来から強い繋がりがあるとされています。今回の発見は、これらの関連疾患の発症メカニズムの解明およびその治療の基盤となる知見を得る端緒になると考えられます。
一方、本研究によって未知のNa+シグナルや浸透圧センサー分子の存在が示唆されました。これらの分子実体を解明することによって体液恒常性維持機構の全体像があきらかになるものと考えられます。研究グループでは、その解明に向けた研究を進めています。
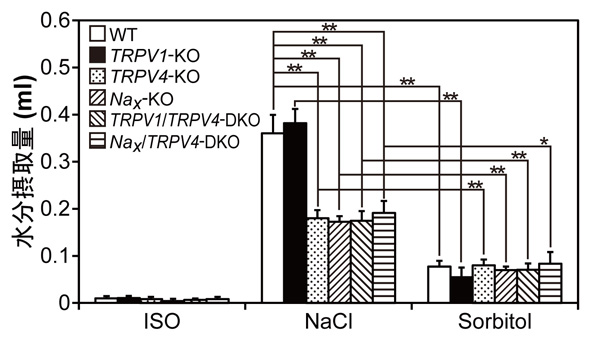
図1 高浸透圧溶液脳室内投与後の水分摂取量
等張溶液(ISO, コントロール)、塩化ナトリウム溶液(NaCl)、ソルビトール溶液(Sorbitol)を脳室内投与後30分間の野生型マウス(WT)、TRPV1欠損マウス(TRPV1-KO)、TRPV4欠損マウス(TRPV4-KO)、Nax欠損マウス(Nax-KO)、TRPV1/TRPV4二重欠損マウス(TRPV1/TRPV4-DKO)、Nax/TRPV4二重欠損マウス(Nax/TRPV4-DKO)の水分摂取量を測定しました。Nax 欠損マウスとTRPV4欠損マウスにおいて、塩化ナトリウム溶液脳室内投与による水分摂取量が野生型マウスやTRPV1欠損マウスの半分程度に減少していました。*P < 0.05; **P < 0.01。
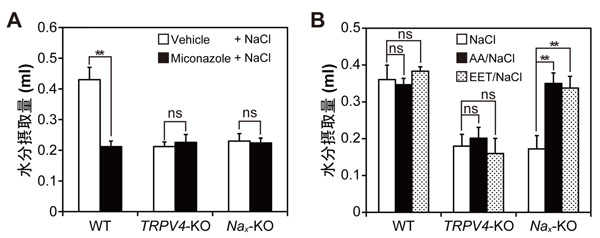
図2 Na+濃度上昇はエポキシエイコサトリエン酸を介して水分摂取を引き起こす
(A)塩化ナトリウム溶液脳室内投与による水分摂取に対するミコナゾール(Miconazole)の影響。ミコナゾールは、エポキシエイコサトリエン酸(EET)がアラキドン酸(AA)から合成されるのを止める働きをする物質です。ミコナゾールは、野生型マウスの水分摂取量をNax欠損マウスやTRPV4欠損マウスと同程度まで減少させました。(B)塩化ナトリウム溶液脳室内投与による水分摂取に対するアラキドン酸およびエポキシエイコサトリエン酸の影響。アラキドン酸とエポキシエイコサトリエン酸は、Nax欠損マウスの水分摂取量を野生型マウスと同程度まで回復させました。Vehicle, 溶媒コントロール。**P < 0.01; ns, not significant。
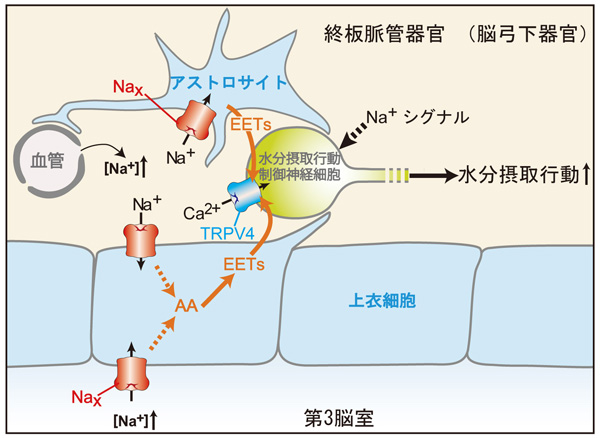
図3 水分摂取行動惹起のシグナル機構
体液中のNa+濃度が上昇すると、Naxが活性化し、それを発現するグリア細胞(アストロサイトと上衣細胞)からTRPV4の内因性リガンドであるエポキシエイコサトリエン酸が放出される。このエポキシエイコサトリエン酸がTRPV4を発現する神経細胞を活性化し、その結果、水分摂取行動が誘発される。この水分摂取行動誘発には、Naxからのシグナルに加えて、未知のNa+シグナルが必要であることがわかっている。AA, アラキドン酸; EETs, エポキシエイコサトリエン酸。
【発表雑誌】
米生理学会誌 American Journal of Physiology - Regulatory, Integrative and Comparative Physiology 8月1日掲載
著者:Hiraki Sakuta, Eri Nishihara, Takeshi Y. Hiyama, Chia-Hao Lin & Masaharu Noda.
【研究サポート】
本研究は、文部科学省科学研究費助成事業等の支援を受けて行われました。
【研究グループ】
本研究は、基礎生物学研究所 統合神経生物学研究部門の野田昌晴教授らの研究グループによって実施されました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 統合神経生物学研究部門
教授:野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846
E-mail: madon@nibb.ac.jp
URL: http://niwww3.nibb.ac.jp/
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp