
基礎生物学研究所




2015.11.20
理化学研究所
自然科学研究機構 基礎生物学研究所
革新的技術による脳機能ネットワークの全容解明プロジェクト
日本医療研究開発機構
霊長類の大脳皮質で多細胞活動を長期間・同時計測
-詳細な脳機能マップ作製のための基盤技術を開発-
理化学研究所(理研)脳科学総合研究センター高次脳機能分子解析チームの山森哲雄チームリーダー、定金理研究員らと、自然科学研究機構基礎生物学研究所光脳回路研究部門の松崎政紀教授、正水芳人助教らの共同研究チームは、2光子顕微鏡[1] と蛍光カルシウムセンサー[2]を組み合わせた手法により、マーモセットの大脳皮質で、長期間にわたり、数百個の神経細胞の活動を同時に計測する技術を開発しました。
ヒトが持つ高次脳機能の基盤メカニズムを解明し、精神・神経疾患を克服するためには、ヒトが属する霊長類の脳をターゲットとした研究が不可欠です。2014年に日本で開始された「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳プロジェクト)」では、新世界ザル[3]であるマーモセットをモデル動物として、霊長類脳の神経ネットワークの全容を細胞レベルで理解することを目標としています。
本研究では、マーモセットの大脳皮質において単一細胞レベルで多細胞の神経活動を長期間にわたって計測し、解析するための技術開発を目指しました。神経活動の計測には、蛍光カルシウムセンサーを神経細胞に発現させる必要がありますが、げっ歯類で使われている従来の方法を霊長類に応用しても蛍光カルシウムセンサーの発現が低く、顕微鏡での観察は困難でした。共同研究チームは、テトラサイクリン発現誘導システム[4]と呼ばれる遺伝子発現誘導システムを用いて、蛍光カルシウムセンサーの発現を増幅することでこの問題を解決しました。これにより、マーモセットの大脳皮質の体性感覚野[5]において、数百個の神経細胞の活動を同時に計測することに成功しました。また、同一の神経細胞の長期間(100日以上)にわたる継続的観察も可能としました。さらに、神経細胞の細胞体だけでなく、樹状突起[6]、軸索[6]からも体性感覚応答[5]を計測することに成功しました。
今後、開発した計測技術を用いた研究によって、知覚・運動・認知など霊長類の脳機能の基盤となる神経ネットワークの理解が大きく進展すると考えられます。また、この計測技術を、精神・神経疾患モデルマーモセットにおける神経ネットワーク変容の理解に役立てることで、新たな治療方法の開発につながると期待できます。
本研究は、日本医療研究開発機構『革新的技術による脳機能ネットワークの全容解明プロジェクト』および『脳科学研究戦略推進プログラム』(両事業とも平成27年度より文部科学省から移管)の一環として行われました。成果は米国の科学雑誌『Cell Reports』に掲載されるのに先立ち、オンライン版(11月19日付け:日本時間11月20日)に掲載されます。
※共同研究チーム
理化学研究所 脳科学総合研究センター 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)
研究員 定金 理(さだかね おさむ)
研究員 渡我部 昭哉 (わたかべ あきや)
自然科学研究機構 基礎生物学研究所 光脳回路研究部門
教授 松崎 政紀(まつざき まさのり)
助教 正水 芳人(まさみず よしと)
大学院生 寺田 晋一郎(てらだ しんいちろう)
1.背景
ヒトが持つ高次脳機能の基盤メカニズムを解明し、精神・神経疾患を克服するためには、ヒトが属する霊長類の脳をターゲットとした研究が不可欠です。2014年に日本で開始された「革新的技術による脳機能ネットワークの全容解明プロジェクト(略称:革新脳プロジェクト、ウェブサイト:http://brainminds.jp/)」は新世界ザルであるマーモセットをモデル動物として、霊長類の高度に発達した脳の神経ネットワークの全容を細胞レベルで理解することを目標としています。同プロジェクトは、米国のBRAIN Initiative、EUのThe Human Brain Projectなどとともに、現在世界的に推進されている脳機能の統合的理解を目指す試みの中の一つに位置づけられます。
マーモセットはヒトと共通性を持った高度に発達した脳を持っています。遺伝子改変技術もすでに進展しており、日本はこの分野で世界をリードしています。
本研究では、霊長類の神経ネットワークを細胞レベルで理解するという目標に向けて、マーモセットの大脳皮質において単一細胞レベルで多細胞の神経活動を長期間にわたって計測し、解析するための技術開発を目指しました。
2.研究手法と成果
細胞レベルで大規模に脳機能を解析するための手段として、2光子顕微鏡と神経活動に伴って蛍光が強くなる蛍光カルシウムセンサーを組み合わせ、神経活動を可視化して計測する手法があります。近年、数百個あるいは千個以上の神経細胞の活動を同時にイメージングする技術が急速に進展し、主にマウスなどげっ歯類を用いた研究に広く用いられています。この技術は従来用いられてきた電気生理学的手法に比べ、時間分解能は劣るものの、細胞の詳細な位置関係の情報を得ることができ、しかも同じ細胞群から繰り返し記録できるという利点があります。
この手法を用いてマーモセット大脳皮質の神経細胞の活動をイメージングするには、蛍光カルシウムセンサーのシグナルが十分に強い必要があります。しかし、これまでげっ歯類で主に用いられていた遺伝子発現方法を霊長類に用いても、蛍光カルシウムセンサーの発現レベルが低く、顕微鏡での観察は困難でした。
共同研究チームは、テトラサイクリン発現誘導システムと呼ばれる遺伝子発現誘導システムを用いて、蛍光カルシウムセンサーの発現を増幅することでこの問題を解決しました。このシステムは本来、ドキシサイクリンなどの薬剤を用いて標的遺伝子の発現をオン、オフするために使用します。一方で、このシステムの特性として遺伝子の発現が増幅されることが知られています。このテトラサイクリン発現誘導システムを組み込んだウイルスベクター[7]をマーモセットの大脳皮質(体性感覚野)に注入し、蛍光カルシウムセンサーの一種であるGCaMP[8]を神経細胞に発現させました。その結果、観察に必要なレベルのGCaMPシグナルを得ることが可能になり、イソフルラン麻酔下において、数百個の神経細胞の自発的活動を観察することに成功しました(図1)。
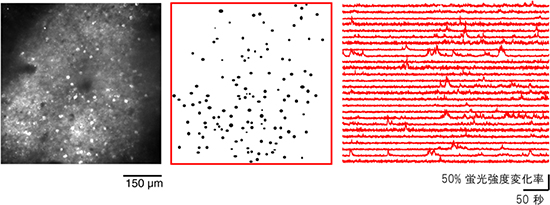
図1 マーモセット大脳皮質神経細胞の自発活動イメージング
左図:マーモセット大脳皮質から2光子顕微鏡を用いて取得した画像(脳表から400μmの深さ)白く見える部分がGCaMPの蛍光シグナル。中図:左図の中で神経細胞の細胞体の部分を抽出し、その位置を黒色で示している。右図:中図が示す細胞体の位置で記録した蛍光シグナルの時間的変化を示している。各波形が1つひとつの神経細胞の細胞体からの記録に対応している。横軸が時間、縦軸が蛍光シグナルの強度変化率を示しており、時々、蛍光シグナルの一時的な上昇、つまり神経細胞の活動が見られることが分かる。
また、今回開発した手法を用いることで、同じ神経細胞群を長期間に渡って観察し続けることが可能になりました。例えば図2に示す例では、100日以上の長期観察に成功しました。同じ神経細胞群を長期間観察することで、例えば動物が学習する際の神経細胞活動を繰り返し記録して、神経ネットワークの変化を解析するような実験が可能となります。

図2 マーモセット大脳皮質神経細胞の長期的観察
左図:テトラサイクリン発現誘導システムを組み込んだウイルスベクターを注入してから10日後に観察した神経細胞群。黄色い矢頭が細胞体を示している。右図:同じ場所をウイルスベクター注入してから113日後に観察した神経細胞群。細胞体の並びが10日後と同じであることが分かる。
さらに、マーモセットの手足に振動刺激を与えたとき、体の感覚の知覚に関わる大脳皮質の特定の場所で、その刺激に応答する神経細胞の活動をイメージングすることにも成功しました。テトラサイクリン発現誘導システムを用いてGCaMPの発現を増幅することで、神経細胞の細胞体だけでなく、樹状突起や軸索といった微細な構造の活動もイメージングできるようになりました(図3)。霊長類の脳で樹状突起や軸索の活動をイメージングすることに成功したのは、世界で初めての成果です。
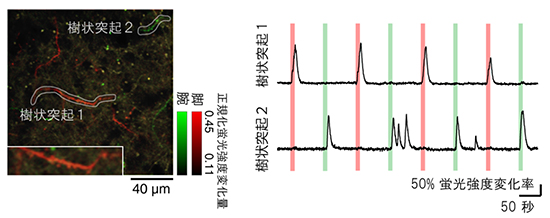
図3 神経細胞の樹状突起から記録した感覚応答
左図:神経細胞から伸びている樹状突起から記録した蛍光シグナル。赤色は脚に、緑色は腕に対する振動刺激によって活動の上昇が見られたことを示している。左下に樹状突起1の拡大図を示す。
右図:左図の樹状突起1と2で記録された感覚応答の時間的変化を示す。縦線の赤色は脚に、緑色は腕に振動刺激を加えたタイミングを示している。樹状突起1は脚への振動刺激に、樹状突起2は腕への振動刺激の後に活動していることが分かる。
3.今後の期待
今後、本研究で開発した神経活動計測技術を用いた研究によって、知覚・運動・認知といった霊長類の複雑な脳機能の基盤となる神経ネットワークの理解が大きく進展すると考えられます。また日本は、次世代まで導入遺伝子が受け継がれる遺伝子改変マーモセットの作製に世界で初めて成功しており、さまざまな精神・神経疾患モデルの作製が進められています。本研究で開発した計測技術を、これらの疾患における神経ネットワーク変容の理解に役立てることで、新たな治療方法の開発につながることも期待できます。
4.論文情報
<タイトル>
<著者名>
Osamu Sadakane#, Yoshito Masamizu#, Akiya Watakabe#, Shin-Ichiro Terada#, Masanari Ohtsuka, Masafumi Takaji, Hiroaki Mizukami, Keiya Ozawa, Hiroshi Kawasaki, Masanori Matsuzaki*, and Tetsuo Yamamori*
(#は同等貢献、*は責任著者)
<雑誌>
Cell Reports
<DOI>
10.1016/j.celrep.2015.10.050
5.補足説明
[1] 2光子顕微鏡
励起光として長波長の近赤外光を用いるため、生体内での散乱の影響を受けにくく、生体深部にある蛍光分子を励起することができる顕微鏡。
[2] 蛍光カルシウムセンサー
カルシウムイオンと結合すると、励起光によって蛍光を発する蛍光分子。
[3] 新世界ザル
広鼻猿類のサルで、南米に生息することから新世界ザル(マーモセットを含む)とも呼ばれる。マーモセットは、近年霊長類のモデル動物としての関心が高まっている。
[4] テトラサイクリン発現誘導システム
tTAと呼ぶ転写因子とTREと呼ばれるtTAに反応する配列を組み合わせ、両方の遺伝子をウイルスベクターによって細胞に発現させることで、TREの下流につなげた遺伝子の発現を調節することができるシステム。本来は、発現させた後、ドキシサイクリン(Dox)投与により、tTAの活性を調節するために用いるが、本実験では、主にtTA-TREの遺伝子発現増幅作用(数十倍)を利用する目的で用いた。
[5] 体性感覚野、体性感覚応答
大脳皮質は機能によって多数の領域に分化しており、そのうち触覚などの体の感覚情報を処理する場所を体性感覚野と呼ぶ。体を触るなどの感覚刺激を加えた際に体性感覚野の神経細胞で見られる活動を体性感覚応答と言う。
[6] 樹状突起、軸索
樹状突起は神経細胞の細胞体から伸びるケーブル上の構造をしており、他の神経細胞からの情報が入力される部位。軸索は、神経細胞の細胞体から伸びるケーブル上の構造をしており、他の神経細胞に情報を出力する部位。多くの場合、樹状突起より長く伸びており離れた部位に情報を送ることができる。
[7]ウイルスベクター
ウイルスのゲノムを利用して任意の遺伝子を発現させる担体(ベクター)の総称で、通常はウイルスの感染性を無くしたものを用いる。
[8] GCaMP
蛍光カルシウムセンサーの1つで、cpEGFP(circularly permuted Enhanced Green Fluorescent Protein)、カルモジュリン、ミオシンのカルモジュリン結合部位M13からなる。カルシウムイオンがカルモジュリンと結合すると、カルモジュリンはM13と結合できるようになり、立体構造が変化し、励起光によって緑色の蛍光を発する。神経細胞が興奮する際には、細胞内のカルシウムイオン濃度が上昇するため、GCaMPを神経細胞に遺伝子発現させることによって、神経活動の可視化ができる。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせ下さい
理化学研究所 脳科学総合研究センター 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)
研究員 定金 理(さだかね おさむ)
TEL:048-462-1111 ex 7251(山森)ex 7251(定金)
FAX:048-467-2539(共通)
E-mail:tetsuo.yamamori@riken.jp(山森)、osamu.sadakane@riken.jp(定金)
自然科学研究機構 基礎生物学研究所 光脳回路研究部門
教 授 松崎 政紀(まつざき まさのり)
助 教 正水 芳人(まさみず よしと)
TEL:0564-55-7681
FAX:0564-55-7684
E-mail:mzakim@nibb.ac.jp(松崎)、masamizu@nibb.ac.jp(正水)
<機関窓口>
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press@riken.jp