
基礎生物学研究所




2009.08.10
基礎生物学研究所 分子細胞生物学研究部門の岡本浩二研究員、岡本徳子研究員および大隅良典教授らのグループは、細胞内のリサイクルシステムにおいて、細胞小器官の一つ、ミトコンドリアだけを特に分別して処理する機構を明らかにしました。ミトコンドリアは細胞内でエネルギーを作り出す重要な細胞小器官ですが、酸化ストレスにさらされて傷つき、不要になったミトコンドリアは分解される必要があります。研究グループは、酵母で新しく発見したAtg32タンパク質が、“分別マーク” のような役割を果たすことにより、古くなったミトコンドリアが分別処理される仕組みを初めて明らかにしました。この成果は、科学専門誌Developmental Cellに掲載されました。
細胞の中には、栄養が不足したり、また不要な物が溜まったりした時に、自身の構成成分を膜で包み込んで輸送し、分解して、細胞内の新たな材料とするリサイクルシステムが備わっています。これをオートファジー(自食作用)と呼びます。オートファジーは、また、細胞内の新陳代謝を高め、異常なタンパク質や構造物を排除し細胞内浄化を行うなど、様々な生命活動において重要な働きをしています。
オートファジーは、栄養飢餓時の大規模かつ非選択的な分解の仕組みとして知られていますが、最近では、特定のタンパク質や細胞小器官を分解するしくみ「選択的オートファジー」も存在すると考えられるようになってきました。しかし、細胞小器官の一つであるミトコンドリアの分解において、本当に選択性があるのかどうか、あるとしたらその仕組みは何かなど、未だ多くの謎に包まれています。
基礎生物学研究所の岡本浩二研究員、岡本徳子研究員および大隅良典教授らのグループは、この細胞内のリサイクルシステムにおいて、細胞小器官の一つ、ミトコンドリアだけを特に選別して分解する仕組みを新たに発見しました。
ミトコンドリアは、「細胞の発電所」とも呼ばれ、細胞内においてエネルギー生産を行う場です。しかし、そのエネルギー生産の過程で、タンパク質を傷つけてしまう危険な活性酸素を生み出してしまいます。活性酸素の酸化ストレスによって、ミトコンドリアは傷ついていきます。研究グループは、出芽酵母(パンやビールの製造に使われる微生物)の細胞内を、電子顕微鏡を使って詳細に観察することにより、不要となったミトコンドリアが選択的にオートファジーの仕組みを使って分解されていることを初めて明確に示しました。
次に、研究グループは、ミトコンドリアが選択的にオートファジーによって分解される仕組みを探りました。酵母の生存に必須でない遺伝子を破壊した変異体を数多く(約5,150種)用意し、ミトコンドリアを蛍光タンパク質で標識しました。そして、それぞれの変異体でミトコンドリアが分解される様子を、蛍光顕微鏡を用いてつぶさに観察しました。その結果、オートファジーによるミトコンドリアの分解が生じない変異体を発見しました。
この変異体では、これまでに機能が知られていないタンパク質を作り出す遺伝子が壊れていました。このタンパク質をAtg32と名付けて解析を進めた結果、Atg32タンパク質がミトコンドリアの分解に必要な因子であること(図1)、Atg32はミトコンドリアの外膜に突き刺さって存在すること、また、オートファジーを生じさせるタンパク質(Atg8, Atg11)と相互作用することが分かりました。
酵母細胞が活発に呼吸して増殖する過程で、ミトコンドリアに活性酸素が溜まってゆきます。蓄積した活性酸素による酸化ストレスにさらされると、ミトコンドリアの表面にAtg32タンパク質が多く付くようになると考えられます。このAtg32タンパク質が“分別マーク”として働き、この目印が付いたミトコンドリアは選択的にオートファジーにより分解されるという仕組みが明らかになりました(図2)。
本研究により、ミトコンドリアが選択的にオートファジーによって分解されることが明確に示されました。また、ミトコンドリアの分解の選択性を規定する因子が初めて明らかとなりました。これまでも、酵母をモデルとした解析は、オートファジーについての理解を飛躍的に深め、ヒトを含めた幅広い多細胞生物での研究を促進してきました。本研究によって得られた分子機構を手がかりとして、様々な生物種におけるミトコンドリア分解の解析が展開してゆくことが期待されます。また、最近、不良なミトコンドリアの蓄積と、神経の機能を損なう病気発症との関連性が指摘されており、この種の発病のしくみの解明にも繋がると期待されます。
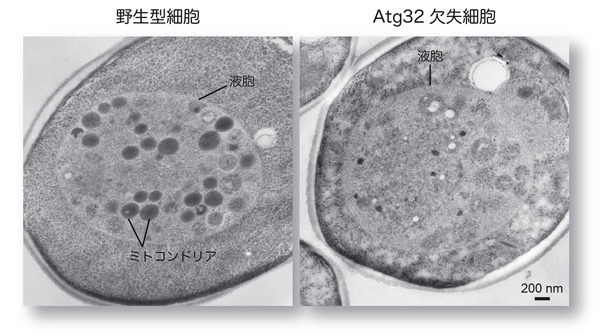 図1:選択的ミトコンドリア分解の電子顕微鏡解析
図1:選択的ミトコンドリア分解の電子顕微鏡解析
オートファジーの仕組みを使って隔離され、細胞内のリサイクル処理場である液胞に運ばれた構造物を調べるため、液胞内分解活性を持たない出芽酵母株を用いて、電子顕微鏡による微細構造の観察を行いました。野生型細胞では、色の濃い(電子密度の高い)構造体、すなわちミトコンドリアが液胞内に多数蓄積しています。これに対し、Atg32タンパク質を持たない細胞の液胞内には、ミトコンドリアは見られません。これらの結果から、Atg32タンパク質がミトコンドリアの分解に必要な因子であることが分かりました。
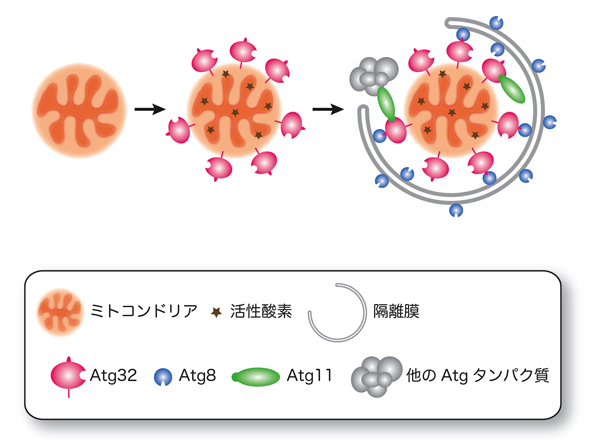 図2:Atg32によるミトコンドリア・オートファジー制御のモデル
図2:Atg32によるミトコンドリア・オートファジー制御のモデル
ミトコンドリアでの活発なエネルギー変換の過程で、次第に活性酸素が蓄積し、それが酸化ストレスとなってミトコンドリアを傷つけます。この際、未知の機構によってAtg32タンパク質の発現が強く誘導され、ミトコンドリア外膜上に突き刺さります。Atg32タンパク質は、オートファジー関連(Atg)タンパク質であるAtg8およびAtg11と相互作用し、これら2つの因子をミトコンドリア表面に連れてきます。Atg11タンパク質を足場として、さらに他のAtgタンパク質が集まってきます。このようにして集められたAtgタンパク質群は、2重の膜構造を形成します。この膜構造が伸長して、隔離膜と呼ばれる袋をつくり、Atg32が存在するミトコンドリアを包み込んでゆきます。隔離膜につつまれたミトコンドリアは、加水分解酵素を含む液胞に運ばれ処理されます。このような仕組みでミトコンドリアが分別・処理されると考えられます。
Developmental Cell
デベロップメンタル セル 電子版 7月21日号 掲載
論文タイトル:
"Mitochondria-Anchored Receptor Atg32 Mediates Degradation of Mitochondria via Selective Autophagy"
著者:Koji Okamoto, Noriko Kondo-Okamoto, and Yoshinori Ohsumi
本研究は、基礎生物学研究所 分子細胞生物学研究部門 (岡本浩二 研究員、岡本徳子 研究員、大隅良典 教授) の研究成果です。
本研究は文部科学省科学研究費補助金のサポートを受けて実施されました。
基礎生物学研究所 分子細胞生物学研究部門
研究員 岡本 浩二 (おかもと こうじ)
(現在の所属: 東京工業大学 統合研究院 先進研究機構)
Tel: 045-924-5879 (研究室)
E-mail: kokamoto@iri.titech.ac.jp
基礎生物学研究所 広報国際連携室
倉田 智子
Tel: 0564-55-7628
E-mail: press@nibb.ac.jp