
基礎生物学研究所




2007.07.13
基礎生物学研究所 分子細胞生物学研究部門の中戸川 仁 助教および大隅 良典 教授らは、細胞内の分解/リサイクルシステムであるオートファジー(自食作用)における特殊な膜構造を作り出す仕組みを明らかにしました。オートファジーとは、細胞が持つタンパク質や構造体を大規模に分解/リサイクルするための仕組みのことです。オートファジーは細胞内の新陳代謝を高めたり、飢餓時には分解産物からエネルギーを得るなど、様々な生命活動において重要な働きをしています。オートファジーには、分解すべきものを取り囲んで隔離する特殊なふくろ(オートファゴソーム)が必要ですが、このふくろを作り上げる仕組みはこれまで謎に包まれていました。研究グループは、オートファゴソームの形成に必要な「Atg8」という小さなタンパク質に、ふくろの材料となりうる脂質膜同士をつなぎ合わせ、特殊な融合状態(ヘミフュージョン注1)にする機能があることを明らかにしました。さらに、このAtg8の機能は、オートファゴソームの膜を大きく伸ばす段階に重要であることを発見しました。本発見は全く新しい生体膜形成メカニズムを示しており、オートファジーのメカニズム全容解明のための突破口となると期待されます。また最近、オートファジーは細胞内の浄化メカニズムとして、パーキンソン病やハンチントン病注2といった神経変性疾患等の原因となる異常タンパク質の蓄積を防ぐことで、これらの発症に対して抑制的に働くことが明らかとなってきました。本研究は、これら病気の予防法や治療法の開発につながる可能性も秘めています。本研究は、戦略的創造研究推進事業 個人型研究(さきがけ)「代謝と機能制御」研究領域(研究総括:西島正弘)の研究テーマ「オートファジーにおける脂質膜組織化機構の解明(研究者:中戸川 仁、基礎生物学研究所 分子細胞生物学研究部門、助教)」の一環として、同研究所の大隅良典教授らのグループとの共同研究によって得られたものです。今回の研究成果は、米国科学雑誌「Cell(セル)」オンライン版にて2007年7月13日に公開されました。
オートファジーとは、栄養飢餓などに応じて細胞が自身の構成成分(細胞質や細胞内小器官)をオートファゴソームと呼ばれる二重の脂質膜のふくろで包み込んで、リソソームや液胞といった加水分解酵素を豊富に含む場に輸送し、分解する現象(図1)であり、酵母からヒトにいたるまで真核生物が共通して持つシステムです。飢餓時には、オートファジーによるタンパク質の分解で生じるアミノ酸が、新たなタンパク質の合成やエネルギーの生産などに再利用され、細胞は飢えを凌ぐことができます。また、オートファジーは栄養が十分に供給されている場合にも低いレベルで起きており、細胞内の新陳代謝を高めることで様々な変性疾患の原因となる異常タンパク質の蓄積を防ぐ役割も果たしています。この他、オートファジーは、細胞内に侵入した細菌の駆除に働いたり、発生や分化や老化、細胞死、免疫応答といった多彩な生命現象にも関与することが明らかとなってきています。これらオートファジーが関わる生命現象とその破綻による病態発症のメカニズムを理解し、予防や治療法の確立につなげるためには、その基盤となるオートファジーの分子メカニズムの解明が不可欠です。 中戸川が所属する大隅らのグループは、酵母細胞をモデルとし、オートファジーにおける中心的なイベントであるオートファゴソームの形成に必要な遺伝子を多数同定し、その機能について研究を進めてきました。しかし、これまでオートファゴソームの膜形成のメカニズムに直接迫る知見は得られておらず、突破口となる発見が待たれていました。
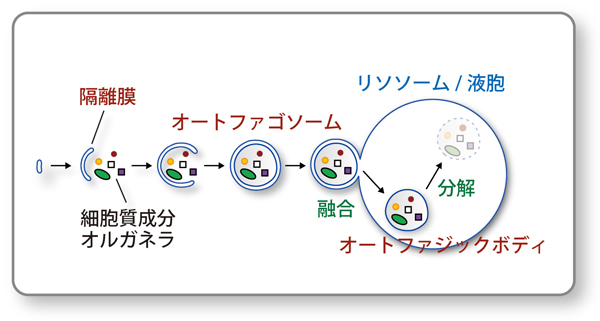
図1:オートファジーの進行過程
オートファジーが誘導されると、細胞質に隔離膜とよばれるカップ状の脂質膜構造が出現します。これが細胞質成分やオルガネラ(細胞内小器官)などを取り込みながら伸展し、最終的に二枚の膜で囲まれたオートファゴソームが形成されます(図中では断面としてリング状に描いていますが、実際には球体です)。続いて、オートファゴソームの外側の膜が、リソソーム(動物細胞の場合)や液胞(植物や酵母細胞の場合)の膜と融合し、オートファゴソームの中身が内側の膜ごとリソソーム/液胞内の加水分解酵素群の作用で消化されます。特に、大きな液胞を持つ植物や酵母細胞の場合には、液胞内の加水分解酵素を不活化することにより、内側の膜で囲まれた球状構造を液胞内に蓄積させ、顕微鏡でこれを観察することが可能です。この構造体はオートファジックボディと呼ばれ、オートファゴソームが正常に形成されていることの指標になります(図3も参照)。
研究グループは、オートファゴソーム形成に必要不可欠な因子として発見したAtg8タンパク質が、具体的にどのようにしてオートファゴソームの形成に関わるのかを調べてきました。その結果、これまでに、Atg8が生体膜を構成する一般的な脂質分子であるホスファチジルエタノールアミン(PE)注3と結合することを見いだしていました。今回中戸川らは、精製タンパク質を用いた試験管内での実験により、Atg8がPEと結合すると複数の分子が集合し、脂質膜同士をつなぎ合わせ、それらを「ヘミフュージョン(hemifusion)」と呼ばれる特殊な融合状態に導くことを発見しました(図2)。ヘミフュージョンは、分泌小胞と細胞膜との融合やウイルスが細胞に侵入する際などに、生体内で起こる膜融合反応の中間段階で共通に観察されるものとして、最近特に注目を集めています。このような普遍的な膜の融合様式が、全く特殊なメカニズムによるものと考えられてきたオートファゴソーム膜の形成にも関与することは予想外のことでした。また同時に、ヘミフュージョンがオートファゴソーム形成に特有な使われ方をされている可能性もあり、本研究成果をもとに活発な議論が巻き起こると予想されます。
本研究では、Atg8がPEと結合すると複数の分子が集合し、自身がアンカーされた膜小胞同士をつなぎ合わせ、ヘミフュージョンという特殊な融合状態に導く機能があることを明らかにしました。
さらに研究グループは、Atg8タンパク質が持つ、脂質膜をつなぎ合わせて、ヘミフュージョンさせる機能が、細胞内でのオートファゴソーム形成においてどのような役割を果たしているのかについて調べました。酵母を用いた実験から、Atg8のこれらの機能が損なわれると、細胞内ではオートファゴソームが形成されなくなることが明らかとなりました(図3)。つまり、Atg8タンパク質による脂質膜のつなぎ合わせとヘミフュージョンはオートファゴソーム形成に必須であることが分かりました。また、Atg8タンパク質のこれらの機能を部分的に失った酵母では、正常な細胞に比べて顕著に小さなオートファゴソームが形成されました。すなわち今回明らかとなったAtg8の機能は、オートファゴソームの膜を大きく伸ばす段階に重要な機能であることが示されました。
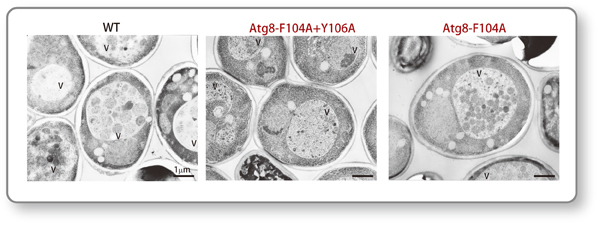 図3:膜のつなぎ合わせとヘミフュージョンの機能に欠損を示すAtg8変異細胞の電子顕微鏡観察像
図3:膜のつなぎ合わせとヘミフュージョンの機能に欠損を示すAtg8変異細胞の電子顕微鏡観察像
酵母細胞においては、オートファゴソームの形成能を液胞内へのオートファジックボディ(図1の説明文を参照)の蓄積として容易に確認することが可能です。左の写真は、オートファジーが正常に起こる野生型の細胞(WT)の電子顕微鏡像ですが、液胞(V)の中に直径500-900nmほどのオートファジックボディがたくさん蓄積していることが分かります。ところが、本研究で同定した膜のつなぎ合わせとヘミフュージョンに著しい欠損を示すAtg8変異細胞(写真中央;F104A+Y106A)では、オートファジックボディの蓄積は見られませんでした。さらに、同機能を部分的に欠損しているAtg8変異細胞(写真右;F104A)では、野生型に比べて明らかに小さなオートファジックボディが蓄積することが分かりました。
今回の研究により、以下の展開が期待されます。
1.オートファゴソームの形成は、比較的研究の進んでいる、小胞体やゴルジ体、核膜といった他の細胞内膜系に関するこれまでの知見では説明できない特殊な膜動態に支えられていると考えられています。しかし、オートファゴソームの膜の材料となる脂質分子が、細胞のどこからどのような形態で、どのようにして集まってくるのかなど、具体的なことについてはほとんど明らかとなっていません。今回、Atg8に新たに見いだされた機能は、これまではっきりしていなかったオートファゴソーム形成における膜動態解明に向けて、初めて具体的な第一歩をしるしたものです。今後、この現象と機能をさらに詳しく解析することで、オートファジーを支える膜動態の全容解明に突破口が開けると期待されます。
2.近年、オートファジーと様々な変性疾患との関連が盛んに報告されています。パーキンソン病やハンチントン病、アルツハイマー病などの神経変性疾患は異常タンパク質の蓄積が原因であり、オートファジーによる異常タンパク質の分解が、病気に対して抑制的に働いていると考えられています。また、このような細胞内の浄化作用は老化とも密接に関係しているとも考えられています。本研究成果は、オートファジーの分子機構の解明を通じて、オートファジーの活性を制御する薬剤のデザインなどを可能とするもので、上記病気の予防・治療法の開発、アンチエイジングの研究などにもつながると期待されます。
注1)ヘミフュージョン:
図2に示したように、脂質膜は主にリン脂質から成る二重層構造をとっています。細胞内で脂質膜は様々なタンパク質の働きにより秩序を持って融合と分裂を繰り返しています。一般的に膜の融合とは、2枚の向かい合った膜が一つながりの大きな膜になることを意味しますが、ヘミフュージョンとは図2に示したような特殊な融合状態になることを指します。すなわち、向かい合った2枚の膜(脂質二重層)のうち、外側の一層同士のみが融合しており、内側の層は元のまま保持された状態です。図中では脂質分子の混ざり合いを表現するため、2つの膜小胞を異なる色の脂質分子で描いてあります。
注2)ハンチントン病:
不随意運動や精神障害、痴呆等を伴う遺伝性の神経変性疾患です。ハンチンチンと呼ばれる遺伝子に変異が入ることにより、神経細胞に変異型タンパク質が蓄積、凝集して細胞死を引き起こすことが原因と考えられています。
注3)ホスファチジルエタノールアミン:
細胞は、図2に示すような脂質分子が二重になってできた「膜」で自己と外界を隔てています。この他にも、細胞の内部にある核やミトコンドリア、小胞体といった細胞内小器官も同じような脂質の膜で仕切られた空間として存在しています。ホスファチジルエタノールアミンは、これら膜の主成分の一つとして、生物界に広く分布しています。
Cell (セル) 2007年7月13日号
論文タイトル:
Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion
(オートファゴソーム形成に必須なユビキチン様タンパク質Atg8は膜のつなぎ留めとヘミフュージョンを媒介する)
著者:Hitoshi Nakatogawa , Yoshinobu Ichimura, and Yoshinori Ohsumi
(中戸川 仁, 一村 義信, 大隅 良典)
本研究は、基礎生物学研究所 分子細胞生物学研究部門の研究グループ(中戸川 仁 助教、一村 義信研究員(現 順天堂大学)、大隅 良典教授 )により実施されました。
本研究は、科学技術振興機構 戦略的創造研究推進事業 「代謝と機能制御」研究領域 個人型研究(さきがけ)のサポートを受けて実施されました。
[本件に関するお問い合わせ先]
基礎生物学研究所 分子細胞生物学研究部門
助教: 中戸川 仁(ナカトガワ ヒトシ)
Tel: 0564-55-7517(研究室)
E-mail: hnakatog@nibb.ac.jp
URL: http://www.nibb.ac.jp/enehen/index-j.html
基礎生物学研究所 連携・広報企画運営戦略室
倉田 智子
Tel: 0564-55-7628
E-mail: press@nibb.ac.jp