自然科学研究機構 基礎生物学研究所
愛媛大学
お茶の水女子大学
植物の液胞は、酵母や動物の液胞と同様に、細胞内の不要物質の分解を担っています。一方、種子に存在する液胞は、発芽時のエネルギー源となる大量のタンパク質を貯蔵するという、分解とは正反対の機能も果たします。豆類や小麦などの種子で液胞に蓄えられる貯蔵タンパク質は、私たちの食生活とも深く関わる重要な農業資源です。
本研究グループはこれまでに、種子における貯蔵タンパク質の液胞への大量輸送を可能にした植物独自の輸送経路の進化的背景を明らかにしてきました。しかし、液胞から別の細胞小器官にタンパク質を輸送する経路が存在するのかどうかについては、これまで全く分かっていませんでした。今回、基礎生物学研究所のFeng Yihong特任助教、海老根一生助教(研究当時/現・埼玉大学)、金澤建彦助教、上田貴志教授(責任著者)を中心とする研究グループは、お茶の水女子大学の伊藤容子特任助教と植村知博教授、愛媛大学の野澤彰准教授と澤崎達也教授、理化学研究所光量子工学研究センターの中野明彦副センター長(研究当時/現 東京科学大学)と連携し、モデル植物シロイヌナズナを用いた解析により、VAMP727とよばれる膜タンパク質を液胞膜からエンドソームへと輸送する細胞内輸送経路の存在を証明し、その過程に関与する分子群を同定することに成功しました。
この過程で働くSNX-BARタンパク質は、植物と動物・酵母の系統において、それぞれ独自の進化を遂げてきており、今回明らかにした輸送経路は植物が独自に獲得した輸送システムであると考えられます。またこの研究は、種子植物に特有の形質である「貯蔵タンパク質の液胞輸送」の進化において、VAMP727のような植物特異的な膜融合装置が、液胞膜からのリサイクリング機構とともに成立してきたことを示唆しています。
本研究成果は、植物が進化の過程で独自に構築した膜交通ネットワークの一端を解明するものであり、細胞生物学および植物科学に新たな知見をもたらすものです。本論文は、2025年10月3日付で英国の国際学術誌『Nature Plants』に掲載されます。
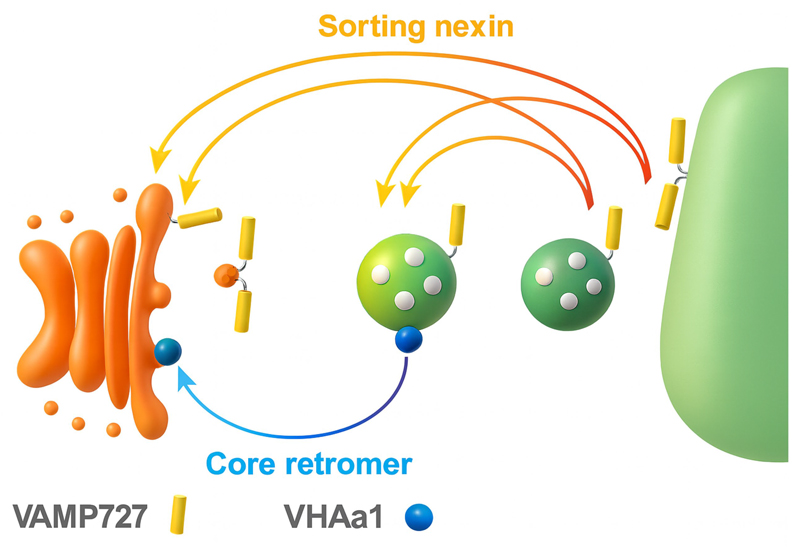
図1 本研究で明らかになった植物における液胞膜やエンドソームからの膜タンパク質回収経路。二つの独立した膜タンパク質回収経路(オレンジ色と青色)が液胞やエンドソームの独自の膜タンパク質組成をつくり出している。
【研究の背景】
真核細胞には、小胞体やゴルジ体、液胞、エンドソームなどの多種多様な細胞小器官(オルガネラ)が存在します。これらのオルガネラはそれぞれ独自のタンパク質組成を有しており、それが、各オルガネラが異なる役割を担う基盤となっています。このオルガネラに固有のタンパク質組成は、小胞や小管を介した物質輸送システムである「膜交通(メンブレントラフィック)」により、確立・維持されています。
各オルガネラ固有のタンパク質組成は、そのオルガネラを起点とする輸送経路と、そこを終点とする輸送経路がバランスすることで実現されます(図2)。小胞体を例に挙げると、小胞体からゴルジ体へ向かう輸送経路(順行輸送)と、ゴルジ体から小胞体へと戻る経路(逆行輸送)のバランスにより、小胞体の機能に必要なタンパク質が正しく局在することが出来るのです。これは、細胞膜を含む膜交通で結ばれた全てのオルガネラに当てはまると考えられます。植物の液胞についても、液胞へとタンパク質を輸送する経路と、液胞からタンパク質を輸送する経路が、液胞機能の発現に必要であろうと想定されます。このうち液胞へ向かう輸送経路については、植物の進化の過程で独自の多様化を果たし、タンパク質の貯蔵を始めとする植物液胞に固有の働きを生み出しています。一方驚いたことに、液胞からタンパク質を輸送する経路が存在するのかどうかについては、これまで分かっていませんでした。我々は、この植物細胞に残された未知の細胞内輸送経路の実在を証明し、その分子機構を明らかにすることを目指して研究を進めてきました。その手がかりとして選んだのが、植物が進化の過程で独自に獲得した膜融合装置であるVAMP727と呼ばれるタンパク質です。
植物のVAMP7ファミリーにはVAMP71とVAMP72の2タイプがあり、基本的に、VAMP71は液胞での膜融合で、VAMP72は細胞膜での膜融合で機能することが分かっています。VAMP727はVAMP72の仲間ですが、他のVAMP72メンバーとは異なり液胞輸送経路においてエンドソームと液胞膜の融合を実行しています。上田教授らのグループは最近、VAMP727が分子進化の過程で酸性アミノ酸に富んだ挿入配列を獲得し、エンドソームと液胞の膜融合を担うように変化したことを突き止めました(2025年5月16日のプレスリリース参照;
https://www.nibb.ac.jp/pressroom/news/2025/05/16.html)。さてここで、液胞での膜融合を実行した後のVAMP727に目を向けましょう。エンドソームに乗って液胞へとやって来たVAMP727は、液胞膜とエンドソーム膜が融合した後は、液胞膜に吸収されることになります。このVAMP727が回収も分解もされなければ、VAMP727はどんどんと液胞膜に蓄積してしまうはずです。しかし実際は、VAMP727は液胞膜にはほとんど局在せず、粒状のエンドソームのみに局在しています。このことから、VAMP727を液胞膜から回収する仕組みがシロイヌナズナに備わっており、それが液胞輸送経路を経て液胞へと至ったVAMP727をエンドソームに戻しているのではないかと考えました。しかし上述の通り、植物細胞において液胞膜からのリサイクリング経路の存在は証明されていませんでした。そこで本研究では、VAMP727が液胞膜から回収されるかどうかを調べることから研究を開始しました。
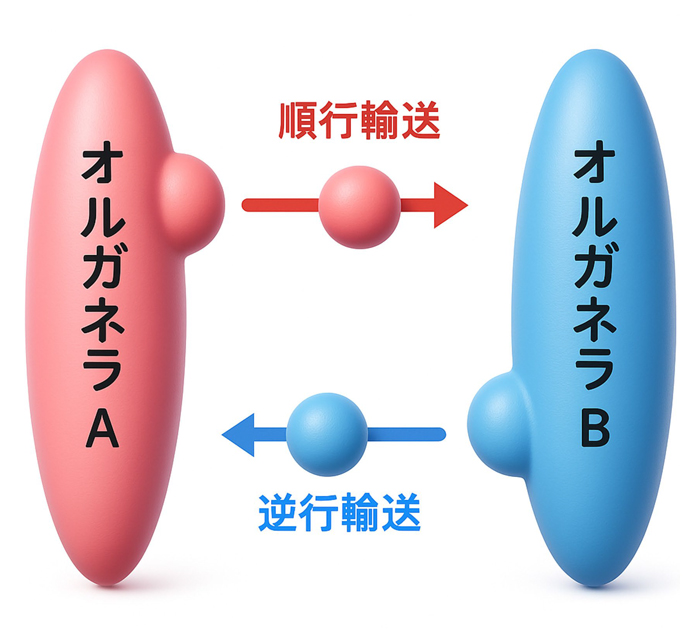
図2 順行輸送と逆行輸送のバランスによりオルガネラタンパク質の組成が決定される
【研究の成果】
研究グループはまず、光によって蛍光色を変化させられるタンパク質「Dendra2」をVAMP727に融合させて標識し、このタンパク質を一過的に液胞膜に蓄積させることで、その後の動きを観察しました。その結果、Dendra2-VAMP727が液胞膜からエンドソームへと移動することを示すことに成功しました。これにより、液胞膜から別のオルガネラへのタンパク質輸送が初めて確認されました。さらに、VAMP727と相互作用する分子を解析し、この液胞からエンドソームへの輸送過程にSNX-BARファミリーに属するSNX1およびSNX2が必須であることを見出しました。加えて、超解像顕微鏡を用いた観察により、液胞膜からVAMP727がSNXタンパク質とともに出芽していく瞬間を直接とらえることにも成功しました。次に、酵母でSNX-BARとともに逆行輸送を担うコアレトロマー複合体(VPS26、VPS29、VPS35)について調べた結果、これらはVAMP727の回収には関与せず、代わりにトランスゴルジ網に局在するVHAa1タンパク質の逆行輸送に必要であることが分かりました。これらの一連の結果から、植物における液胞膜からの逆行輸送経路の存在を明確に示すとともに、その経路におけるSNXタンパク質の役割、そしてSNXとコアレトロマーが独立に機能していることを明らかにしました。植物で独自に進化した液胞機能は、このような膜交通制御の進化と深く関係していると考えられます。以下に、本研究の主要な成果を項目ごとに詳述します。
植物液胞からのリサイクリング経路が存在することを実証
まず、VAMP727を一時的に液胞膜へ蓄積させる条件を探索した結果、リン脂質の合成阻害剤であるWortmannin(Wm)で処理することによってDendra2-VAMP727が液胞膜に集積することを確認しました。Wmの効果は可逆的であるため、紫外線照射により液胞に蓄積したDendra2-VAMP727の蛍光を緑から赤に変換し、Wm除去してその動態を追跡しました。その結果、3時間以内に液胞膜上の赤色Dendra2-VAMP727がほぼすべてエンドソームへ移動することが明らかになりました(図3)。この実験は、VAMP727が液胞膜から回収される仕組みが植物細胞に存在することを初めて明確に示したものであり、従来知られていなかった液胞膜起点の膜交通経路の存在を実証する成果となりました。
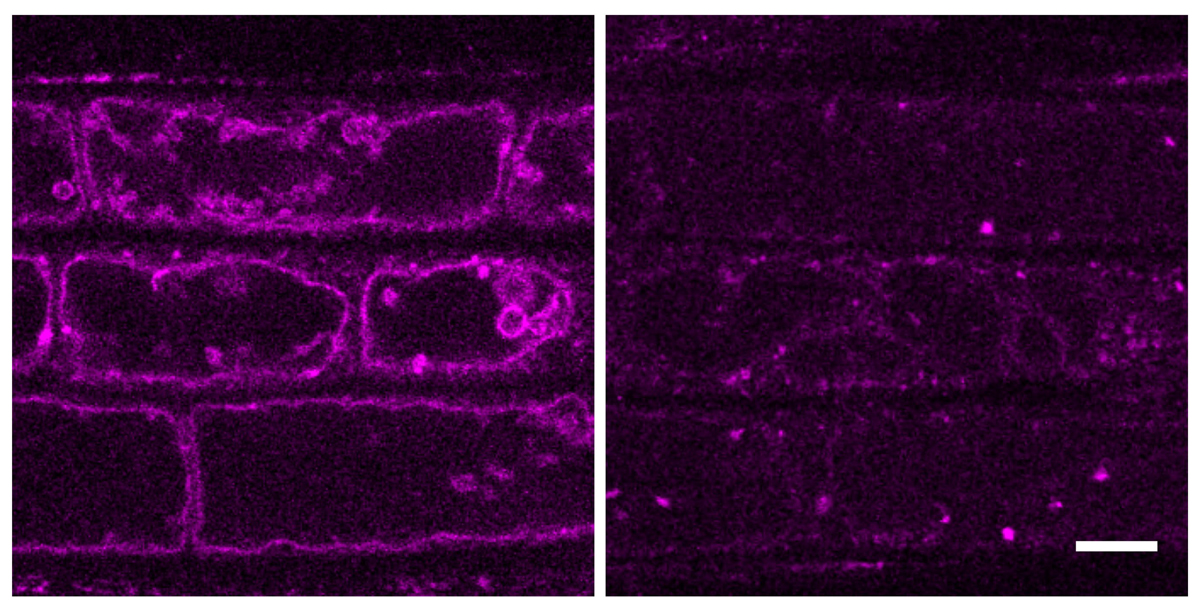
図3 Dendra2-VAMP727の液胞膜からエンドソームへの移行
Dendra2-VAMP727を発現する植物の根の表皮細胞。Wortmannin (Wm) 処理により液胞膜に蓄積したDendra2-VAMP727(左)は、Wm除去後3時間後には粒状の後期エンドソームへと移行する(右)。この時期には液胞膜局在はほとんど観察されない。スケールバーは10 µm。
SNX1およびSNX2がVAMP727の逆行輸送を担う
VAMP727の液胞からの回収に関わる分子機構を解明するため、過去に同定された相互作用因子(Takemoto et al., 2018, PNAS)を再検討し、その中からSNX-BARファミリー(SNX1、SNX2)およびコアレトロマー複合体(VPS26、VPS29、VPS35)に注目しました。これらの変異体を用いてVAMP727の局在を解析したところ、
snx1および
snx2変異体では、VAMP727がエンドソームに戻れず液胞膜に蓄積することが判明しました(図4上段)。一方、コアレトロマー複合体の変異体では、VAMP727のエンドソーム局在に変化は見られませんでした。
さらに生化学的解析では、VAMP727が試験管内でSNX1およびSNX2と相互作用すること、そして植物体内ではSNX1との結合がより強いことを確認しました。このことから、SNX1/2がVAMP727の逆行輸送に直接関与している可能性が強く示唆されました。
これをさらに実証するため、
snx1変異体にDendra2-VAMP727を導入し、液胞膜上に蓄積したDendra2-VAMP727を紫外線で赤色に変換した後、薬剤によってSNX1の発現を誘導し、その後のDendra2-VAMP727の動態を共焦点顕微鏡で観察しました。その結果、SNX1の発現に応じてDendra2-VAMP727が液胞膜からエンドソームへと移動することが確認され、SNXがVAMP727の回収を担う分子であることが実証されました。
さらに、従来の共焦点顕微鏡では空間・時間分解能の限界からこの過程の可視化が困難だったため、超解像ライブイメージング顕微鏡(Super-resolution Confocal Live Imaging Microscopy: SCLIM)を用いて解析したところ、VAMP727とSNX1が一緒に液胞膜から出芽する瞬間を捉えることができました(図4下段)。これにより、SNXタンパク質がVAMP727を液胞膜から回収している様子を視覚的に捉えることができました。加えて、VAMP727がSNX1とともにエンドソームから出芽する様子が観察され、VAMP727のエンドソーム局在が、液胞膜とエンドソームからの逆行輸送の合わせ技で実現されていることが明らかになりました。
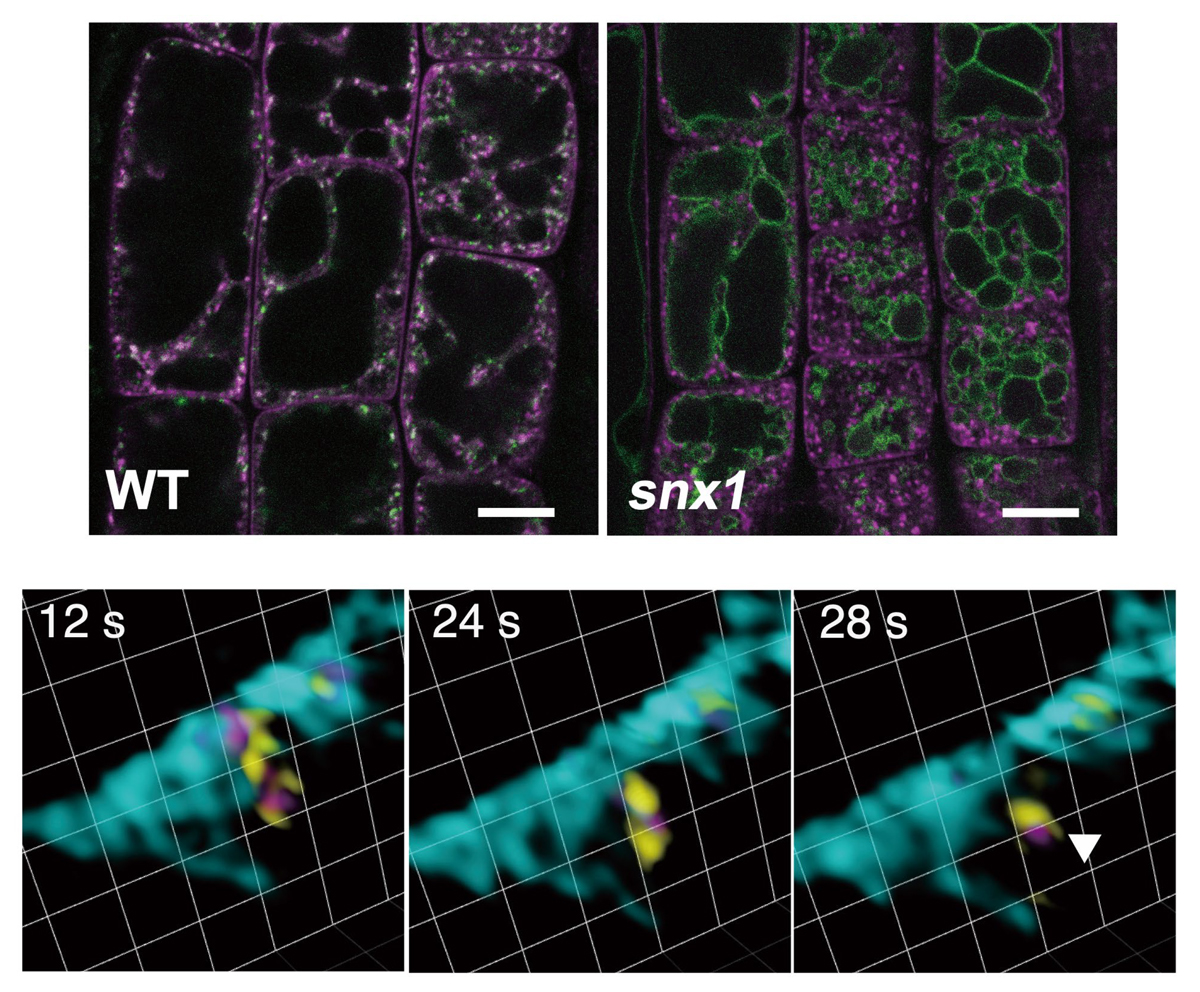
図4 VAMP727はSORTING NEXIN (SNX)により液胞膜から回収される
上段:Venus-VAMP727とmRFP-VAMP721を発現する野生型(左)と
snx1変異体(右)。分泌経路で機能するVAMP721の粒状の局在パターンは
snx1変異体中でも変化しないが、VAMP727は
snx1変異体中で液胞膜に蓄積する。スケールバーは10 µm
下段:超解像ライブイメージング顕微鏡(SCLIM)を用いて、mGFP-VAMP727(黄色)、SNX1-mRFP(マゼンタ)、miRFP-SYP22(液胞膜マーカー、シアン)の動態を経時的に観察した。液胞膜からVAMP727とSNX1が一緒に出芽している。グリッドの一辺は0.942 µm。
SNXとコアレトロマーは異なる逆行輸送を担う
酵母や動物では、エンドソームからゴルジ体への逆行輸送に、SNX-BARとコアレトロマーが協調して働くことが知られています。しかし本研究により、植物ではこれらが独立に機能することが明らかとなりました。続いて我々は、トランスゴルジ網に局在する膜タンパク質VHAa1の逆行輸送に注目しました。コアレトロマー複合体の構成因子であるVPS35やVPS26を欠損した変異体では、VHAa1が誤って液胞に移行していました。一方、SNX1/2の変異体ではVHAa1の局在に変化はありませんでした。これに対して、VAMP727の逆行輸送にはSNXが必須であり、コアレトロマーは不要であることも、先述の実験で示されました。さらに、SCLIMを用いてコアレトロマーとSNXの挙動の超解像観察を行うことで、コアレトロマーとSNXがエンドソームから独立に出芽する様子を捉えることが出来ました(図5)。
これらの結果は、植物においてSNXとコアレトロマーが異なる積み荷タンパク質の逆行輸送を、それぞれ独立に担っていることを示しています。
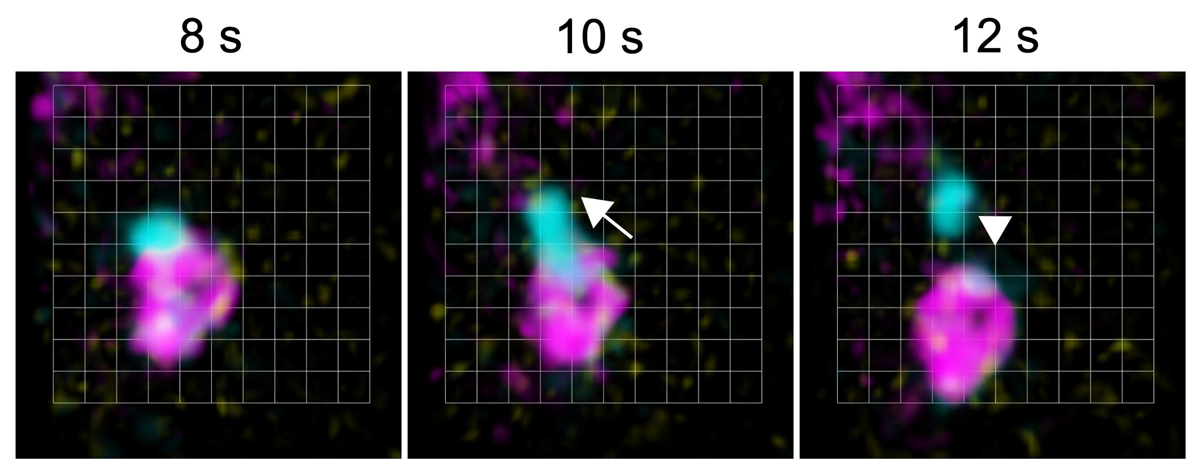
図5 SNXとコアレトロマーは異なる逆行輸送経路で働く。
超解像ライブイメージング顕微鏡(SCLIM)を用いて、VPS35b-iRFP(コアレトロマー、シアン)、SNX1-mRFP(マゼンタ)、GFP-ARA7(エンドソームマーカー、黄色)の動態を経時的に観察した。エンドソームからVPS35bが出芽するが、そこにはSNX1は局在していない。グリッドの一辺は0.426 µm。
【今後の展望】
本研究により、植物における液胞からエンドソームへの輸送経路(液胞からエンドソームへの逆行輸送経路)の存在と、その担い手となるSNXタンパク質の働きが明らかとなりました。これは、植物が独自に進化させた膜交通システムを理解する上で重要な知見です。特に、SNXとコアレトロマーが異なるタンパク質を対象に、それぞれ独立した逆行輸送経路を構成していることは、植物固有の細胞内輸送ネットワークの存在を裏付けるものです。今後は、SNXによって回収されたVAMP727が細胞内のどこへとまず運ばれるのかを明らかにすることが重要です。また、VAMP727以外にも液胞膜からリサイクリングされる膜タンパク質が存在する可能性があり、それらの全容解明により、植物独自の液胞機能発現機構の全体像がさらに明らかになると期待されます。本研究で明らかになった植物特有の輸送経路は、膜交通の進化と多様化を読み解く手がかりとして、今後の細胞生物学や進化学の発展にも貢献することが期待されます。
【発表雑誌】
雑誌名 Nature Plants
掲載日 2025年10月3日
論文タイトル: Retrieval from vacuolar/endosomal compartments underpinning neofunctionalization of SNARE in plants
著者: Yihong Feng, Kazuo Ebine, Yoko Ito, Takehiko Kanazawa, Tatsuya Sawasaki, Akira Nozawa, Tomohiro Uemura, Akihiko Nakano, Takashi Ueda
DOI:
10.1038/s41477-025-02115-5
【報道解禁日】
2025年10月3日 18時
【研究グループ】
本研究は、基礎生物学研究所 細胞動態研究部門のYihong Feng特任助教、海老根一生助教(研究当時/現 埼玉大学)、金澤建彦助教、お茶の水女子大学 基幹研究院の植村知博教授及びヒューマンライフサイエンス研究所の伊藤容子特任助教、理化学研究所 光量子工学研究センターの中野明彦副センター長(研究当時/現 東京科学大学)、愛媛大学 先端研究院 プロテオサイエンスセンターの野澤彰准教授と澤崎達也教授が参加した共同研究チームにより実施されました。
【研究サポート】
本研究は、科学研究費助成事業(19H05670, 19H05675, 21H02515, 24K02050, 23KF0078, 21K06222)、武田科学振興財団、生命創成探究センター(ExCELLS)特別共同研究プログラム(No. 23-S3 and 24-S2)の支援を受けて行われました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 細胞動態研究部門
教授 上田 貴志 (ウエダ タカシ)
TEL: 0564-55-7530
E-mail: tueda@nibb.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp
お茶の水女子大学 広報・ダイバーシティ推進課
TEL: 03-5978-5105
E-mail: info@cc.ocha.ac.jp
愛媛大学 総務部広報課
TEL: 089-927-9022
E-mail: koho@stu.ehime-u.ac.jp





 図1 本研究で明らかになった植物における液胞膜やエンドソームからの膜タンパク質回収経路。二つの独立した膜タンパク質回収経路(オレンジ色と青色)が液胞やエンドソームの独自の膜タンパク質組成をつくり出している。
図1 本研究で明らかになった植物における液胞膜やエンドソームからの膜タンパク質回収経路。二つの独立した膜タンパク質回収経路(オレンジ色と青色)が液胞やエンドソームの独自の膜タンパク質組成をつくり出している。
 図3 Dendra2-VAMP727の液胞膜からエンドソームへの移行
図3 Dendra2-VAMP727の液胞膜からエンドソームへの移行 図4 VAMP727はSORTING NEXIN (SNX)により液胞膜から回収される
図4 VAMP727はSORTING NEXIN (SNX)により液胞膜から回収される 図5 SNXとコアレトロマーは異なる逆行輸送経路で働く。
図5 SNXとコアレトロマーは異なる逆行輸送経路で働く。