光に応答するタンパク質を用いて細胞や個体をコントロールする光遺伝学と呼ばれる手法は、近年、生物学の多様な分野で広く用いられるようになってきました。ヒトと共通する部分が多く、研究が進んでいる線虫においても光遺伝学の応用が進んでいます。今回、基礎生物学研究所/生命創成探究センターの小田茂和元助教、海老根映美研究員、中村彰伸研究員(現: 産業技術総合研究所)、青木一洋教授らは、名古屋市立大学の木村幸太郎教授のグループとの共同研究により、赤色光に応答する光遺伝学を利用して線虫の行動を光でコントロールすることに成功しました。
これまでの線虫の研究では、紫外光や青色光などの短波長の光に応答する光遺伝学ツールが使われていました。しかし、線虫は青色光を嫌う習性があることから、これらのツールを使用するには青色光に反応しない変異体の線虫を使用する必要がありました。変異体を用いた研究では生理機能への影響が少なからず考えられるため、青色光を用いない光遺伝学的ツールが期待されていました。本研究では、赤色光/近赤外光に応答するフィトクロムB(Phytochrome B, PhyB)とその結合因子PIFからなるPhyB-PIFシステム、さらにPhyBの光応答に必要なフィコシアノビリン(PCB)を細胞内で合成させるシステム(SynPCB)を導入することで、線虫の細胞内シグナル伝達系を赤色光で操作することに成功しました。さらに、腸の細胞内のカルシウム濃度を制御することにより、線虫の排便リズムを光でコントロールすることに成功しました。
本研究で使われたPhyB-PIFとSynPCBを線虫に適用することで、将来的には線虫の細胞内シグナル伝達と行動の関連性をより直接的に理解することができると期待されます。
本成果は、国際学術誌「ACS Synthetic Biology」に2023年2月21日付で掲載されました。
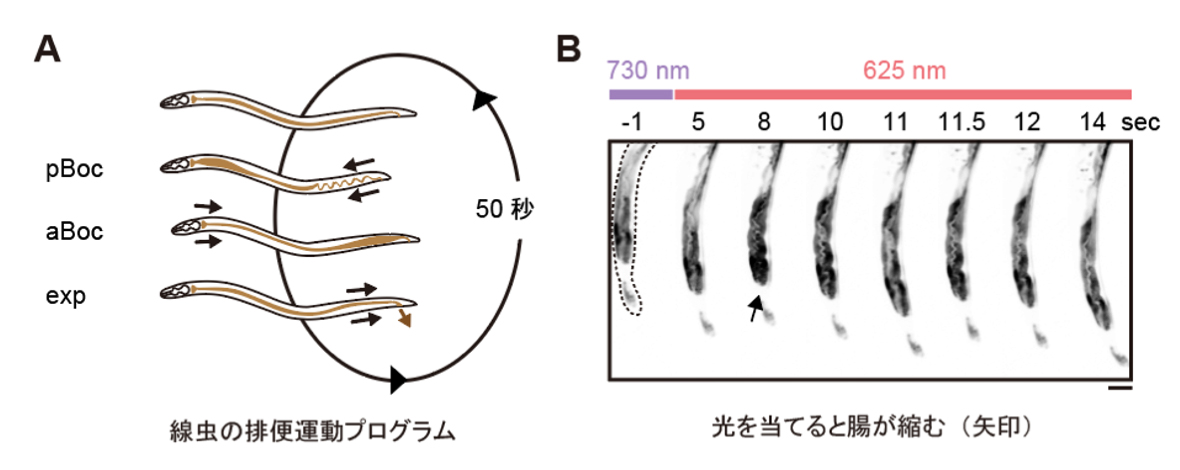
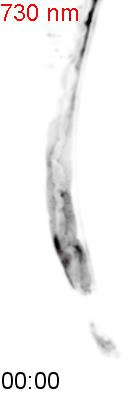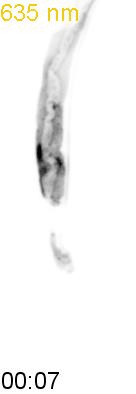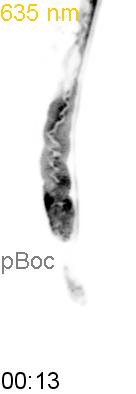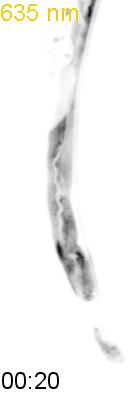
図:赤色光によって腸の細胞内のカルシウム濃度を制御し、線虫の排便リズム(DMP)を光でコントロールすることに成功
【研究の背景】
線虫は、飼育のしやすさやライフサイクルの短さなどから幅広い研究分野で用いられています。多細胞であることから個体レベルでの行動や表現型の研究に適したモデル実験動物のひとつです。これまでの線虫の研究では、遺伝子破壊や薬剤処理といった撹乱(摂動)を与えてその応答を観察するというアプローチが主にとられていました。しかし、これらの手法は摂動するタイミングやその空間的な位置を任意にコントロールすることは技術的に困難でした。それに代わる方法として、近年では光でタンパク質、細胞、個体を制御することが出来る光遺伝学の応用が期待されています。光を用いることによって非侵襲的に任意のタイミングで遺伝子発現やタンパク質の活性を操作することが出来るようになります。線虫でも青色光に応答するチャンネルロドプシンを用いて神経細胞を操作したり、青色光に応答するタンパク質を使って細胞内のシグナル伝達を操作したりすることが可能となってきています。しかしながら線虫は、紫-青色光受容体であるLITE-1を有しており、LITE-1を介して青色光や紫外線などの短波長の光に対して回避行動(負の光走性)を示すことが知られています。そのため青色光の光遺伝学ツールを使用する場合、LITE-1を欠損した変異体の線虫が使用されてきました。しかしながら、変異体を用いた研究では生理機能への影響を慎重に検討する必要があり、より長波長の光を用いる光遺伝学ツールの応用が期待されていました。
本研究では、赤色光/近赤外光に応答するフィトクロムB(Phytochrome B, PhyB)とその結合因子であるPIFを利用した光遺伝学システムを線虫に導入し、線虫の細胞内シグナルや行動の操作を目指しました。
【研究の成果】
PhyBは高等植物に存在する赤色光/近赤外受容体タンパク質です。PhyBが光に応答するためには、フィトコロモビリンやフィコシアノビリン(PCB)と呼ばれる発色団が必要であることが知られています(図1A)。しかし、これらの発色団は植物やラン藻で合成されますが、それ以外の動物では合成されません。したがって、PhyBとその結合因子のPIFを使った光遺伝学システムを動物細胞で利用するには、ラン藻からPCBを抽出、精製し、それを細胞に添加する必要があります。そこで、研究グループはまず、線虫に精製したPCBを添加し、PCBがどの組織まで浸透するかを確認しました(図1B)。線虫の餌である大腸菌にPCB溶液を添加して、腸、神経、体壁筋におけるPCBの浸透を観察したところ、腸まではPCBが浸透していることを確認できましたが、神経や体壁筋といったより深い組織では確認されませんでした。これらの結果は、線虫の神経や体壁筋といった組織では、精製したPCBを用いたPhyB-PIFを利用することができないことを示していました。
そこで、研究グループは以前に本グループで開発したSynPCBシステムを線虫に応用することにしました。SynPCBシステムは、PCB合成ができない生物においてPCBを合成させる遺伝子システムのことです(図1C)。シアノバクテリアは4つの遺伝子産物を使ってヘムからビリベルジン、さらにPCBへと代謝することでPCBを合成し、光合成に利用します。そこでSynPCBシステムでは、シアノバクテリアが持っているPCB合成にかかわる4遺伝子(PcyA、HO1、Fd、Fnr)を遺伝子工学的に単離し、さらにヘムが豊富に存在するミトコンドリア内にこれらの遺伝子産物を発現させるようにしています。このSynPCBシステムを改良したSynPCB2.0と呼ばれる遺伝子を線虫に導入し、PhyB-PIFシステムに必要なPCBが線虫の組織で合成されるかを検討しました。その結果、期待通り、腸だけでなく神経や体壁筋においてもPCBの合成が確認できました(図1D)。
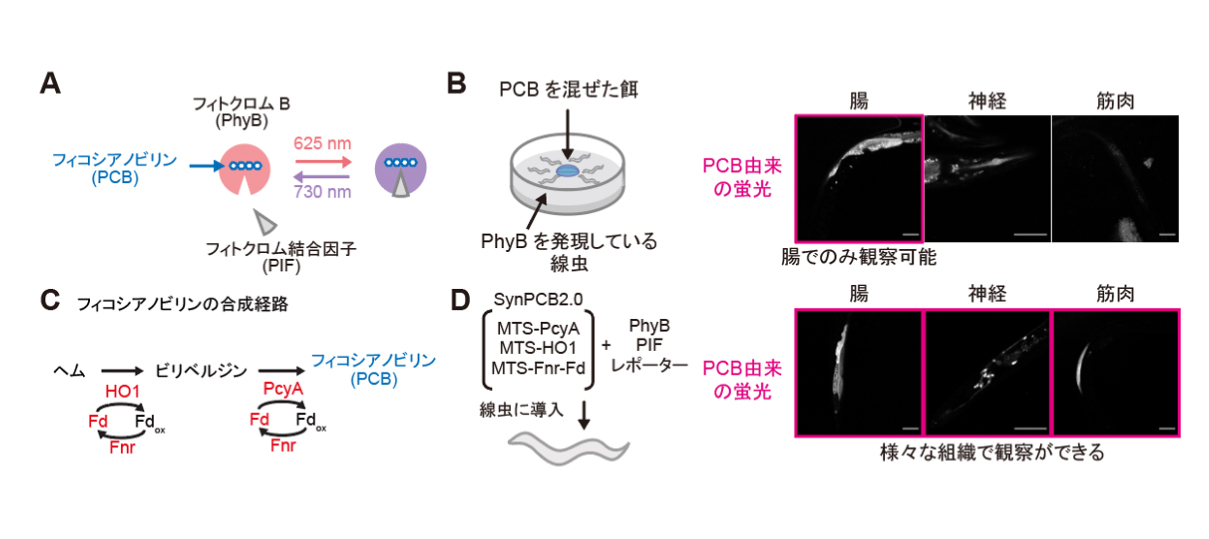
図1: 赤色光/近赤外光に応答する光遺伝学スイッチPhyB-PIFとフィコシアノビリン合成系SynPCBシステムの線虫への応用
(A) フィコシアノビリン(PCB)を発色団として持つフィトクロムB(PhyB)は、赤色光(625 nm)で結合因子のPIFと結合し、近赤外光(730 nm)で解離する。
(B) 左の図は、シアノバクテリアから精製したPCB溶液を線虫に添加し、PCBが線虫組織内に浸透するかどうかを調べた実験。右の写真は、PhyBの変異体に結合したPCB由来の蛍光を示している。腸からはPCB由来の蛍光が観察されるが、神経、体壁筋からはPCB由来の蛍光は観察されなかった。
(C) フィコシアノビリンの合成系。PCB合成には4つの酵素(HO1, PcyA, Fd, Fnr)が必要である。
(D) 左の図は、PCBの合成に必要な遺伝子発現システムSynPCB2.0とPhyB、PIFシステムの線虫への導入を示している。右の写真は、SynPCB2.0システムを用いて線虫の腸や神経、体壁筋においてPCBが合成させることが可能となった。
次に、研究グループは、線虫内で合成されたPCBがPhyBの赤色光に対する応答に十分であるかどうかを調べるために、PhyBとPIFの赤色光/近赤外光依存的な結合と乖離を観察しました。そのために、PhyBとPIFを結合させるとPIFの細胞内での局在が変化する実験系を構築しました。PhyBに脂質修飾シグナルを付与することで形質膜直下に局在させ、緑色蛍光タンパク質mNeonGreenを融合したPIFを細胞質に発現させ、赤色光を当てるとPIF-mNeonGreenが形質膜に移動するのが観察されるようにデザインしました(図2上)。その結果、赤色光を照射するとPIF-mNeonGreenが期待通り形質膜に移行し、近赤外光を当てると細胞質に戻ることが観察されました(図2下)。これらの結果から、SynPCBシステムにより、線虫内においてPhyB-PIFを使った光遺伝学スイッチを利用可能であることを示しました。
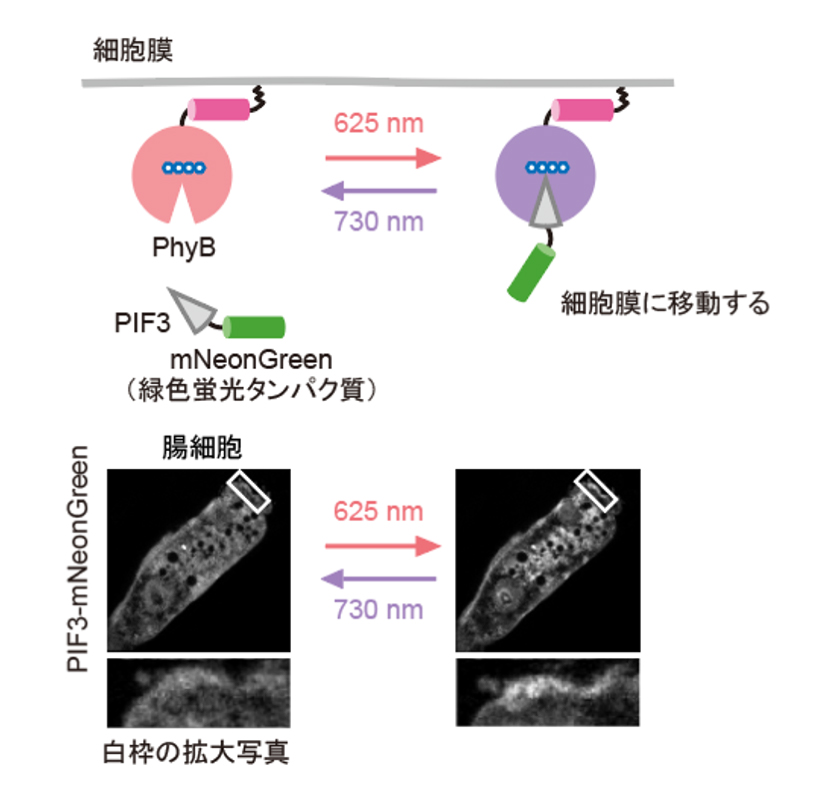
図2: PhyB-PIFシステムを用いた赤色光/近赤外光依存的な局在変化
細胞質に局在するPIF-mNeonGreenは、赤色光照射によって細胞膜に局在するPhyBに結合し細胞膜に移動する。PhyBとPIFの複合体は、近赤外光によって解離しPIF-mNeonGreenは細胞質に戻る(図上)。線虫の腸の細胞内に発現したPIF-mNeonGreenは赤色/近赤外光依存的に細胞質と細胞膜を行き来する(図下)。
動画:
https://www.nibb.ac.jp/pressroom/news/uploads/20230309/movie1.gif
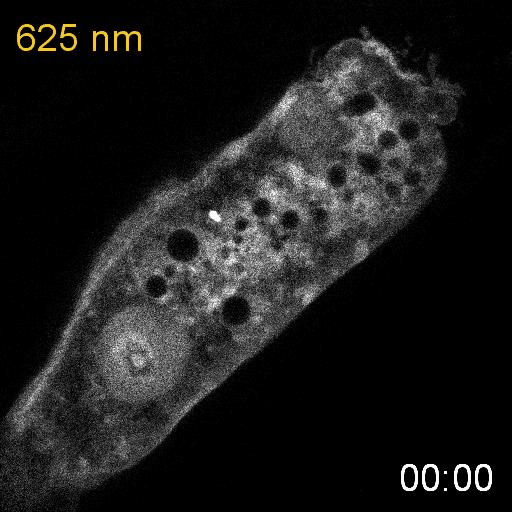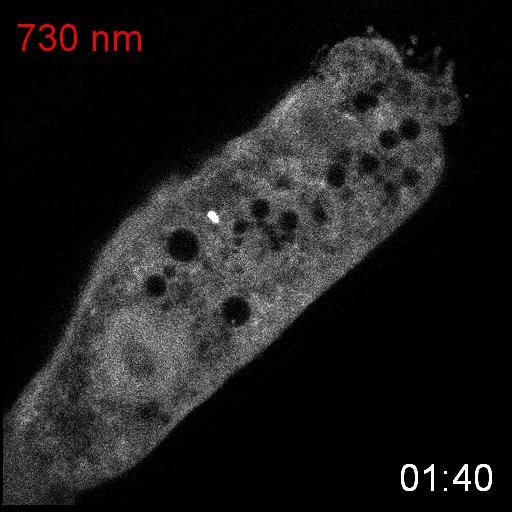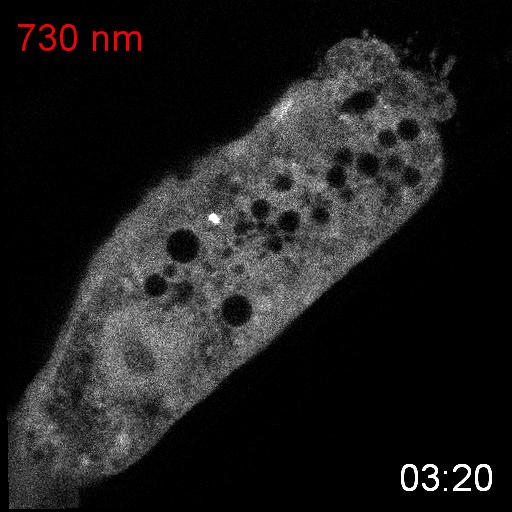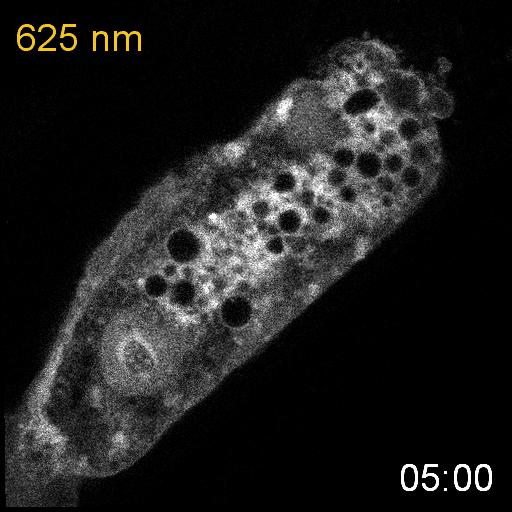
次に、研究グループは線虫個体内の細胞内シグナル伝達を赤色光/近赤外光によって操作することを試みました。培養細胞で既に報告のあるカルシウムイオン(Ca
2+)の細胞質放出の系を線虫に導入しました。このシステムでは、細胞質に局在するPIF-Gaqが形質膜に局在するPhyBと結合し形質膜に移行すると、ホスホリパーゼCベータ(PLCb)が活性化して、小胞体からCa
2+が放出されます。(図3A)。カルシウムレポーターであるGCaMP6sをSynPCBシステムおよびPhyB-PIF光遺伝学スイッチと同時に線虫の腸内に導入し、赤色光を照射したところ、赤色光の照射によりCa
2+濃度を急激に上昇させることに成功しました(図3B)。
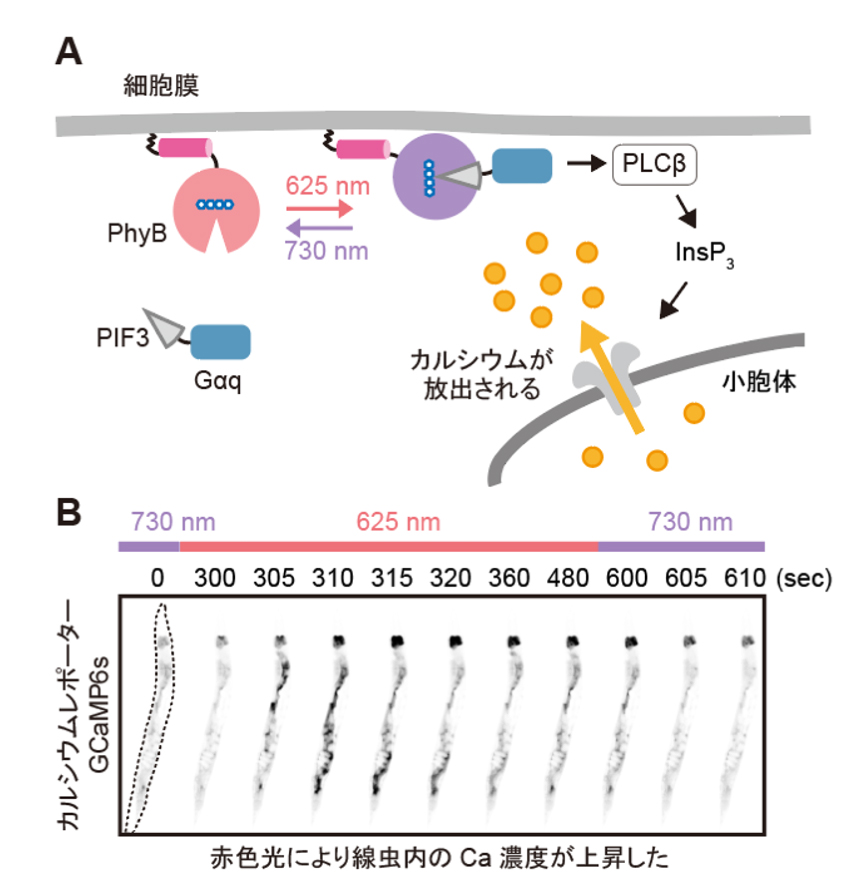
図3: PhyB-PIFおよびSynPCBシステムによる線虫の腸の細胞内におけるCa
2+濃度の光操作
(A) PhyB-PIFシステムを用いた細胞内Ca
2+濃度の光操作の模式図。赤色光照射によりPIF-GaqがPhyBと結合して細胞膜に移行し、PLCbを活性化する。PLCbによって生成されたイノシトール1,4,5-三リン酸(InsP
3)は、小胞体上の受容体に結合し、小胞体からのCa
2+の放出を誘導する。
(B) AのPhyB-PIFおよびSynPCBシステムを導入した線虫をビーズで固定し、赤色光/近赤外光を照射したときのCa
2+濃度の変化を示した。
動画:
https://www.nibb.ac.jp/pressroom/news/uploads/20230309/movie2.gif
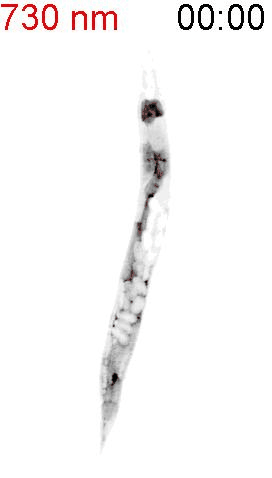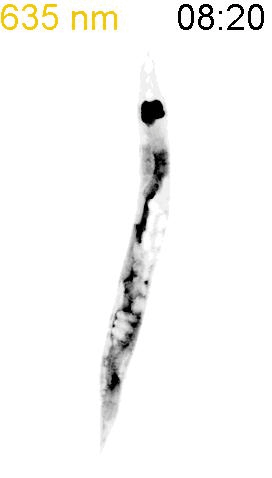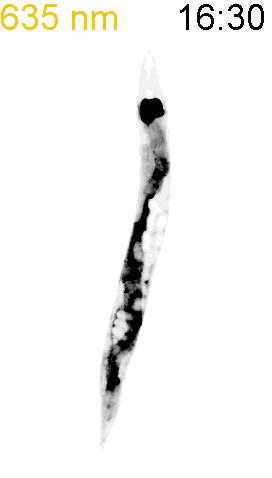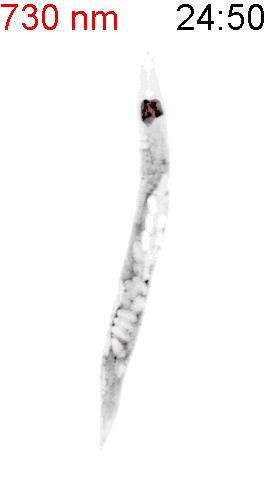
最後に、光による線虫の行動を操作できるか試みました。線虫の排便運動プログラム(defecation motor program, DMP)は、摂食時に約50秒ごとに引き起こされる周期的な排便行動です。DMP時に、腸の細胞のCa
2+濃度が上昇することが知られています(図4A)。DMPでは、Ca
2+濃度上昇後、体後部の体壁筋で収縮が起こり、腸の内腔のジグザグ模様が見られます(posterior body muscle contraction, pBoc)。次に、体前部の筋収縮が起こり(anterior body muscle contraction, aBoc)、腸内容物の排出(expulsion, exp)が起こります。DMPに関わる遺伝子は遺伝学的な手法でいくつか同定されていますが、Ca
2+濃度の上昇のみでDMPを誘導できるのかといったCa
2+とDMPの因果関係に関しては十分には明らかにされていませんでした。そこで研究グループは、図3の線虫を用いて、自由行動している線虫に赤色光/近赤外光を照射し、腸内の細胞のCa
2+濃度を上昇させた際に、DMPが引き起こされるかどうかを調べました。その結果、赤色光を照射すると体後部の収縮が起こり腸管内腔のジグザグ模様が観察され、pBocが引き起こされていることが確認されました(図4B)。これらの結果から、腸の細胞においてCa
2+濃度が上昇すると、DMPの最初のステップであるpBocが引き起こされることが明らかになりました。

図4: 赤色光によるCa
2+の上昇が線虫の排便運動プログラム(DMP)を誘導する
(A) 線虫の排便運動プログラム。体後部の腸周辺の筋収縮が起こり、便を体前部へ集め(posterior body muscle contraction, pBoc)、その後に体前部の筋収縮により便を体後部へ送る(anterior body muscle contraction, aBoc)。最後に、便を排出する(expulsion, exp)。
(B) 図3AのPhyB-PIFおよびSynPCBシステムを導入した線虫に赤色光を当てたときの腸の様子。赤色光を照射すると、腸の内腔がジグザグの形態を示すことから、pBocが起きていることが分かる。
動画:
https://www.nibb.ac.jp/pressroom/news/uploads/20230309/movie3.gif

【今後の展望】
本研究では、赤色光/近赤外光の光遺伝学ツールであるPhyB-PIFシステムとSynPCBシステムを線虫に応用することに成功しました。さらに赤色光/近赤外光を用いた線虫の行動制御も可能であることを示しました。しかしながら、線虫にSynPCBを高発現させると毒性が出てくることとも確認され、適用には注意が必要であることも分かりました。また、SynPCBだけでなくPhyBやPIFも導入する必要があり、線虫に導入する複数の遺伝子の発現量を最適化する必要もあります。これらは、ゲノム編集などの方法で外来遺伝子を線虫のゲノムの適切な位置に組み込むことにより改善できることが見込まれます。将来的にはPhyB-PIFシステムとSynPCBシステムを利用し、線虫やより大型の動物における細胞内シグナル伝達と行動の関連性の理解につながることが期待されます。
【発表雑誌】
雑誌名 ACS Synthetic Biology
掲載日 2023年2月21日
論文タイトル: Optical control of cell signaling with red/far-red light-responsive optogenetic tools in
Caenorhabditis elegans.
(線虫における赤色光/遠赤外光によるシグナル伝達系の光操作)
著者:Shigekazu Oda*, Emi Sato-Ebine*, Akinobu Nakamura, Koutarou D. Kimura, and Kazuhiro Aoki
(*co-first authors)
DOI:
https://pubs.acs.org/doi/10.1021/acssynbio.2c00461
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの青木一洋教授、名古屋市立大学の木村幸太郎教授による共同研究グループの成果です。
【研究サポート】
本研究は、下記の補助金による支援を受けて実施されました。
日本学術振興会科研費・基盤研究(B)(22H02625:青木一洋)
日本学術振興会科研費・基盤研究(B)(21H02533:木村幸太郎)
日本学術振興会科研費・学術変革領域研究(A)「サイバー・フィジカル空間を融合した階層的生物ナビゲーション」(21H05299:木村幸太郎)
日本学術振興会科研費・新学術領域研究「共鳴誘導で革新するバイオイメージング」(18H04754:青木一洋)
日本学術振興会科研費・新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」(19H05798:青木一洋)
科学技術振興機構CREST(JPMJCR1654:青木一洋)
ExCELLS課題研究(シーズ発掘)(22EXC206:木村幸太郎、青木一洋)
【本研究に関するお問い合わせ先】
基礎生物学研究所 定量生物学研究部門
生命創成探究センター 定量生物学研究グループ
教授 青木 一洋 (アオキ カズヒロ)
TEL:0564-59-5235
E-mail:k-aoki@nibb.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL:0564-55-7628
FAX:0564-55-7597
E-mail:press@nibb.ac.jp
自然科学研究機構 生命創成探究センター 研究戦略室
TEL:0564-59-5885
FAX:0564-59-5202
E-mail:press@excells.orion.ac.jp
名古屋市立大学 総務部広報室広報係
TEL:052-853-8328
FAX:052-853-0551
E-mail:ncu_public@sec.nagoya-cu.ac.jp




 図:赤色光によって腸の細胞内のカルシウム濃度を制御し、線虫の排便リズム(DMP)を光でコントロールすることに成功
図:赤色光によって腸の細胞内のカルシウム濃度を制御し、線虫の排便リズム(DMP)を光でコントロールすることに成功
 図1: 赤色光/近赤外光に応答する光遺伝学スイッチPhyB-PIFとフィコシアノビリン合成系SynPCBシステムの線虫への応用
図1: 赤色光/近赤外光に応答する光遺伝学スイッチPhyB-PIFとフィコシアノビリン合成系SynPCBシステムの線虫への応用 図2: PhyB-PIFシステムを用いた赤色光/近赤外光依存的な局在変化
図2: PhyB-PIFシステムを用いた赤色光/近赤外光依存的な局在変化
 図3: PhyB-PIFおよびSynPCBシステムによる線虫の腸の細胞内におけるCa2+濃度の光操作
図3: PhyB-PIFおよびSynPCBシステムによる線虫の腸の細胞内におけるCa2+濃度の光操作
 図4: 赤色光によるCa2+の上昇が線虫の排便運動プログラム(DMP)を誘導する
図4: 赤色光によるCa2+の上昇が線虫の排便運動プログラム(DMP)を誘導する