理化学研究所
東京大学大学院理学系研究科
中部大学
基礎生物学研究所
理化学研究所(理研)環境資源科学研究センター細胞機能研究チームの坂本優希研修生(東京大学大学院理学系研究科博士課程)、杉本慶子チームリーダー(東京大学大学院理学系研究科教授)、中部大学の鈴木孝征教授、前島正義教授、基礎生物学研究所の瀬上紹嗣助教らの国際共同研究グループは、いったん分化を完了した植物細胞がリプログラミング
[1]を起こし、植物体を再生する仕組みを解明しました。
本研究成果は、組織培養技術を用いた植物資源の増産やゲノム編集
[2]を用いた品種改良の効率化につながるものであり、持続的な食料供給やバイオマス生産に貢献すると期待できます。
今回、国際共同研究グループは、分化した細胞がリプログラミングし、分裂を再開するためには、植物ホルモンのオーキシン
[3]を新たに作り出す必要があることを発見しました。また、この時、オーキシンの生合成酵素をコードする遺伝子の発現がエピジェネティック
[4]な仕組みによって上昇することを明らかにしました。さらに、オーキシンの合成によって細胞のオーキシンに対する応答性が高まり、細胞分裂を再開させるために必要な遺伝子の発現が誘導されることが分かりました。
本研究は、科学雑誌『
The Plant Cell』オンライン版(8月4日付:日本時間8月4日)に掲載されます。
【背景】
植物の体細胞は完全に分化した後でもリプログラミングを起こし、細胞分裂と細胞分化を通して完全な植物個体を再生することができます(図1)。これは、植物細胞が分化を完了した後も分化全能性
[5]を保持していることを示す重要な知見ですが、その仕組みを解明しようとする研究はこれまでほとんど行われてきませんでした。
杉本慶子チームリーダーらは、これまでに植物が新たな器官を再生する仕組みについて研究を進め、植物細胞のリプログラミングを転写レベルで制御する仕組み
注1-4)や、エピジェネティックレベルで制御する仕組み
注5,6)を明らかにするなど、世界に先駆けて重要な成果を発表してきました。
これまで植物の再生の分子経路の解明を目指した国内外の研究の多くは、植物組織内の比較的分裂能の高い細胞や組織を利用したものがほとんどでした。今回、国際共同研究グループは、分化の進んだ細胞を単離し、一つの分化細胞から再生を起こす再現性の高い実験系を新たに確立し、その仕組みの解明に取り組みました。
注1)2011年3月11日プレスリリース「植物細胞の脱分化を促進するスイッチ因子を発見」
https://www.riken.jp/press/2011/20110311/
注2)2017年1月17日プレスリリース「植物が傷口で茎葉を再生する仕組み」
https://www.riken.jp/press/2017/20170117_2/
注3)2018年2月15日プレスリリース「植物の再生を司る遺伝子制御ネットワーク」
https://www.riken.jp/press/2018/20180215_1/index.html
注4)2021年8月20日プレスリリース「植物の再生と防御のスイッチ」
https://www.riken.jp/press/2021/20210820_2/index.html
注5)2015年6月30日プレスリリース「植物の分化全能性抑制の分子メカニズムの一端を解明」
https://www.riken.jp/press/2015/20150630_1/
注6)2019年11月4日プレスリリース「植物細胞のリプログラミングの仕組みを分子レベルで解明」
https://www.riken.jp/press/2019/20191104_1/index.html
【研究手法と成果】
国際共同研究グループはまず、シロイヌナズナ
[6]の成熟葉を酵素処理することで、分化の進んだ葉肉細胞
[7]から細胞壁を取り除いたプロトプラスト
[8]を単離し、その後オーキシンとサイトカイニン
[3]を含む培養液中で生育させて植物体を再生する実験系を確立しました(図1)。この条件下では、およそ2%のプラトプラストが1週間以内に細胞分裂を再開し、カルスと呼ばれる細胞塊を形成するため、分化細胞からのリプログラミングを定量的に評価することが可能になりました。
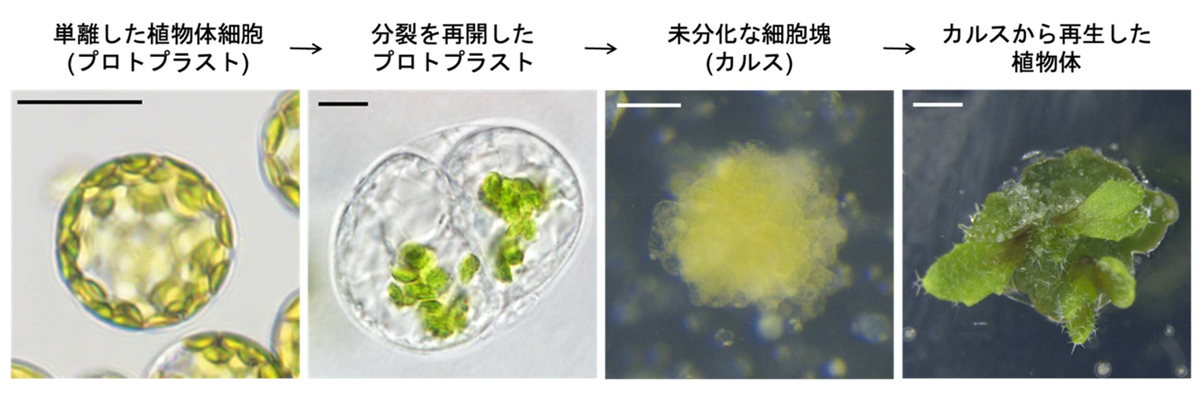
図1 分化した体細胞がリプログラミングし、細胞増殖を繰り返して植物個体を再生するまでの過程
成熟葉から酵素処理によって単離されるプロトプラストをオーキシンとサイトカイニンを含む培養液中で生育すると細胞分裂が再開し、カルス形成を経て、植物体が再生する。スケールバーは左から25mm、10 mm、100 mm、1mm。
分化細胞からのリプログラミングには、ダイナミックな遺伝子発現変動を伴うことが予想されました。そこで、クロマチン構造
[9]を変化させて遺伝子発現を活性化する、ヒストンH3タンパク質
[10]のアセチル化の関与を検討しました。その結果、アセチル基転移酵素であるHAG1
[11]、HAG3
[11]、HAF1
[11]を介して起きるヒストンアセチル化
[12]が分化細胞からのリプログラミングに必要であることが分かりました(図2)。
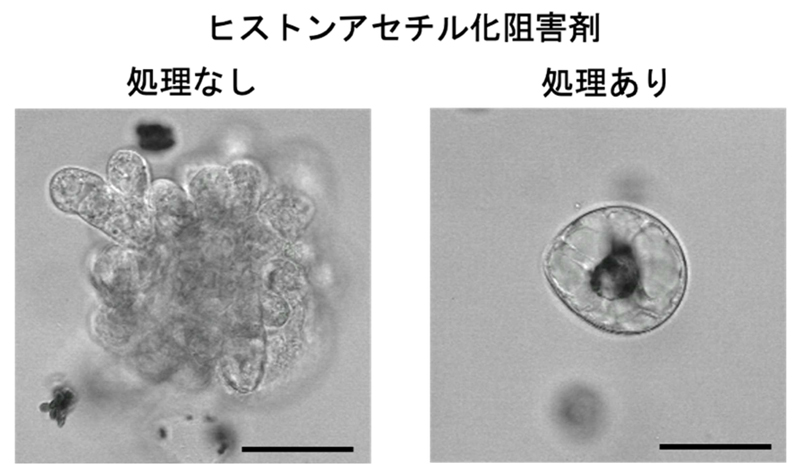
図2 分化細胞からのリプログラミングに対するヒストンアセチル基転移酵素の阻害の影響
通常、細胞は分裂を再開し、カルスを形成する(左図)。ヒストンのアセチル化が阻害された細胞は分裂を再開できないため、カルス形成が起きない(右図)。スケールバーは50 mm。
次に、ヒストンアセチル化によってどんな遺伝子の発現が誘導されるのかを調べました。阻害剤を処理してヒストンアセチル化を抑制した条件下と処理していない条件下で、遺伝子発現変動をRNA次世代シーケンス法
[13]によって解析したところ、オーキシンの生合成酵素YUCCA(YUC)
[14]をコードしている遺伝子の発現がヒストンアセチル化に依存して上昇することが分かりました。そこで、YUCを介したオーキシン合成が実際に分化細胞からのリプログラミングに関与するかどうかを調べたところ、細胞が分裂を再開するまでに新たなオーキシンを合成することが特に重要であることが分かりました。またオーキシン合成が細胞のオーキシンに対する応答を高めることも明らかになりました。
阻害剤を処理しない通常条件での細胞周期
[15]関連遺伝子の発現変動から、単離直後の葉肉プロトプラストは細胞分裂周期のG1期にあり、培養を開始してから数日以内にS期に移行したのち、引き続きG2/M期に入ると予測されます。興味深いことに、薬剤によってオーキシン合成を阻害してもS期に見られる遺伝子発現には大きな変化はなく、一方で、G2/M期遺伝子の発現が著しく抑制されました。このことから、新たに作られるオーキシンは特にG2/M期遺伝子の発現を誘導するために必要であることが示されました。
オーキシンに応答した遺伝子発現の制御にはAUXIN RESPONSE FACTOR(ARF)
[16]と呼ばれる転写因子
[17]が関与することが知られています。シロイヌナズナには23種類のARFがありますが、中でも、プロトプラストで合成されるオーキシンはARF7とARF19の発現に必要でした。またこれらのARFが、G2/M期遺伝子の発現を制御するマスターレギュレーター
[17]の一つであるMYB3R4
[18]をコードする遺伝子の発現を上昇させることで、その制御下にある200個近くのG2/M期遺伝子の発現を誘導していることが分かりました(図3)。
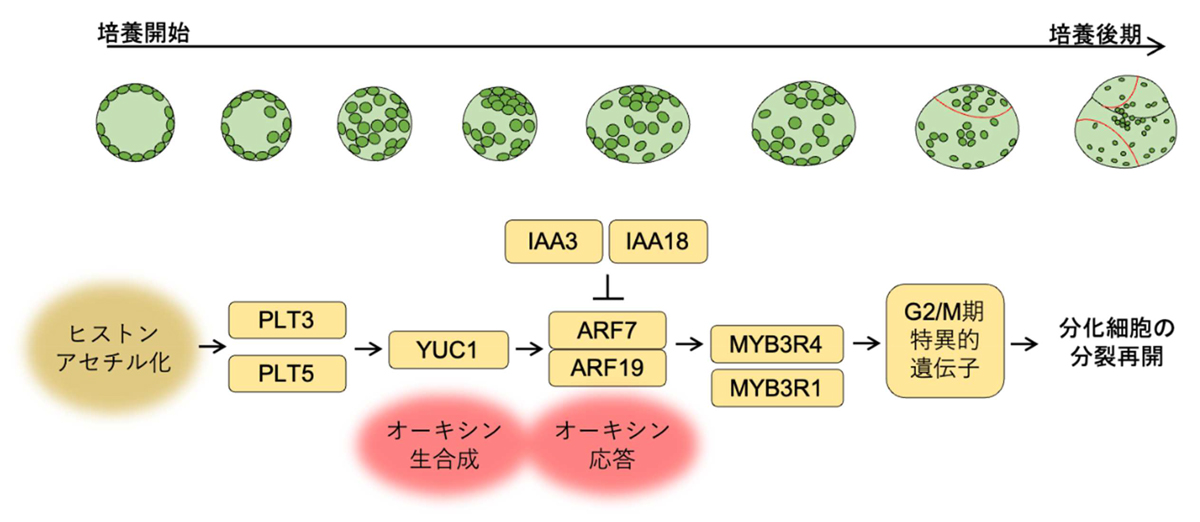
図3ヒストンのアセチル化を介した分化細胞のリプログラミングの仕組み
ヒストンのアセチル化によりオーキシン生合成酵素YUC1の発現が上昇し、細胞内のオーキシン応答が高まることで、ARF7とARF19転写因子が活性化する。その結果、細胞周期制御のマスターレギュレーターの一つであるMYB3R4の発現が上昇して、その制御下にあるG2/M期特異的遺伝子(約200個)が発現し、細胞分裂が再開する。
【今後の期待】
本研究から、分化した植物細胞がリプログラミングを起こし、細胞分裂を再開するためには細胞内でオーキシンを新たに作り出す必要があることが明らかになりました。通常の発生過程においてはいったん分裂を終了し、分化した細胞が分裂を再開することはありませんが、プロトプラストという特殊な細胞環境下で起きるヒストンのアセチル化によってクロマチン構造が変化し、オーキシン生合成遺伝子が発現するようになって、分裂を再開するために必要な細胞周期因子が再び細胞内に蓄積するようになると考えられます。
今後、人為的にヒストンのアセチル化レベルを操作したり、細胞内のオーキシン量を上昇させたりすることで、他の植物種の分化細胞からもリプログラミングを誘導できるようになれば、組織培養技術を用いた植物資源の増産やゲノム編集を用いた品種改良をさらに効率化することが可能になると期待できます。
本研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)
[19]」のうち、「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献するものです。
【論文情報】
<タイトル>
Transcriptional activation of auxin biosynthesis drives developmental reprogramming of differentiated cells
<著者名>
Yuki Sakamoto, Ayako Kawamura, Takamasa Suzuki, Shoji Segami, Masayoshi Maeshima, Stefanie Polyn, Lieven De Veylder, Keiko Sugimoto
<雑誌>
The Plant Cell
<DOI>
10.1093/plcell/koac218
【補足説明】
[1] リプログラミング
分化した体細胞が発生運命を変えること。厳密な定義として、分化した細胞が発生過程で獲得したエピジェネティック修飾を初期化し、分化多能性を持った幹細胞へと変化することを示すが、最近では、細胞の脱分化、再分化、分化細胞から別の分化細胞への転換(ダイレクトリプログラミング)などを総称して用いられることも多い。
[2] ゲノム編集
生物が持つゲノムDNA上の特定の塩基配列を人為的に変更する操作のこと。遺伝子組換え操作が外来の遺伝子を細胞に導入して新たな形質を付加する操作であるのに対し、ゲノム編集は細胞が元来持っているDNAを細胞内部で変化させる操作である点が特徴である。
[3] オーキシン、サイトカイニン
どちらも植物ホルモンの一種。植物ホルモンとは、植物によって生産され低濃度で植物の生理過程を調節する成長調節物質である。オーキシンは細胞伸長を促進することで植物の成長を促す作用があり、植物の一生のさまざまなシーンで重要となる植物ホルモンである。またサイトカイニンは、オーキシン存在下で細胞分裂や茎葉形成を促進する一群の因子と定義される。
[4] エピジェネティック
近年、DNAのメチル化やDNAが巻き付くヒストンタンパク質の化学修飾(メチル化やアセチル化など)によって、遺伝子発現のしやすさが変化し、かつその状態が細胞分裂後の娘細胞や場合によっては次世代に受け継がれることが分かってきた。このような、遺伝子の本体であるDNAの塩基(A、T、G、C)の並び方の変化に依存しないで起こる遺伝子発現の制御や伝達を研究する研究分野を、エピジェネティクス(epi-後生的な、genetics-遺伝学)と呼ぶ。エピジェネティックはその形容詞的用法をする語で、もっぱらDNAメチル化やヒストン修飾によって支配される遺伝子発現の制御状態を示す。
[5] 分化全能性
一つの細胞が個体を構成する全ての細胞種に分化できる潜在能力のこと。受精卵は分化全能性を持っている。植物細胞では、葉肉細胞のプロトプラストや花粉の細胞からも細胞分裂活性化を経て個体を再生できることから、分化を完了した細胞においても分化全能性を発揮できる。
[6] シロイヌナズナ
アブラナ科の植物であり、「ぺんぺん草」で知られるナズナの近縁種である。持っている遺伝子の総量が比較的少なく、発芽から開花し種子が採れるまでの時間が比較的短いことから、植物のモデル生物(普遍的な生命現象の解明に用いられる代表的な生物)の一つになっている。2000年に、植物として初めて全ゲノムが解読された。
[7] 葉肉細胞
葉の上下の表皮組織の間にある柔細胞のこと。一般に被子植物においては、主に柵状組織(向軸側)および海綿状組織(背軸側)を形成している。発達した葉緑体や液胞を持つ分化細胞であり、葉の光合成器官として重要な役割を担っている。
[8] プロトプラスト
日本語では原形質体といい、植物細胞から、その外側を覆っている細胞壁を取り除いた裸の細胞のこと。実験的には、植物組織を高浸透圧の液に浸して細胞壁と原形質(細胞膜と細胞核、および細胞質)とを分離させ、さらにセルラーゼなどの細胞壁分解酵素で処理することで得られる。細胞壁がないため物理的なストレスに弱く、少しの衝撃や浸透圧変化で壊れてしまう。このプロトプラストを用いて、細胞融合や外来遺伝子の導入など細胞工学的に重要な操作を行うことができる。
[9] クロマチン構造
膨大な遺伝情報を小さな細胞核に収めるためには、DNAをコンパクトに収納する必要がある。DNAがヒストンタンパク質に巻き付いたものをヌクレオソームと呼び、このヌクレオソームがさらに凝集したものがクロマチンである。クロマチンの凝集が強い場合は、DNAに転写因子などが結合できず遺伝子の発現調節ができないが、凝集が弱い状態では、DNAがさまざまな因子の影響を受けやすくなる。このように、クロマチン構造は単にDNAをパッケージするためだけでなく、遺伝子の発現制御にも関与することが分かっている。
[10] ヒストンH3タンパク質
DNAを巻きつけて核の中に収納するタンパク質の一種。ヒストンには、中心的なものとしてはH2A、H2B、H3、H4の4種類がある。H2AとH2B、H3とH4が結合したものがさらに結合し8量体を形成し、DNAを巻き付けている。ヒストンH3タンパク質は、メチル化、アセチル化などの化学修飾を受け、それが遺伝子発現などに影響を与えることが明らかになりつつある。
[11] HAG1、HAG3、HAF1
ヒストンにアセチル化修飾を行うヒストンアセチル化酵素(histone acetyltransferase:HAT)の一種。シロイヌナズナでは、HAG1、HAG3、HAF1を含めて全12種類のヒストンアセチル化酵素が発見されている。
[12] ヒストンアセチル化
ヒストンにアセチル基が付加されるヒストン修飾のこと。ヒストンアセチル化が起こると、ヒストンとDNA間の電気的な結合が弱くなり、クロマチン構造が緩むと考えられている。この結果、転写因子など種々の因子がDNAへアクセスしやすくなり、遺伝子の発現などがコントロールされる。逆に、ヒストンの脱アセチル化(アセチル化の除去)が起こると、クロマチン構造が凝縮することで、遺伝子発現制御が抑えられる。
[13] RNA次世代シーケンス法
次世代シーケンサーを用いて、ある細胞、組織で発現する遺伝子の種類と発現量を網羅的に捉える方法。RNAを抽出したのち、相補的なDNAに変換したものの配列を読むことで、ゲノムのどこの配列がどれくらい転写されていたかを見積もる。
[14] YUCCA(YUC)
フラビンとNADPH/NADHを補酵素とする酸化還元酵素(フラビンモノオキシゲナーゼ)の一種で、インドール-3-ピルビン酸からオーキシンであるインドール-3-酢酸(IAA)を作り出す。シロイヌナズナでは、全部で11種類の
YUCCA遺伝子が発見されている。
[15] 細胞周期
真核生物において、分裂した後の細胞一つがまた二つの娘細胞へと分裂して増える一連の現象。顕微鏡による観察から間期(G1期、S期、G2期)と有糸分裂期であるM期に分けられる。細胞周期はG1、S、G2、M期と回ることで1週する。増殖を停止する場合は静止期(G0)に入る。
[16] AUXIN RESPONSE FACTOR(ARF)
オーキシンに応答した遺伝子の転写変化を担う転写因子の一群。シロイヌナズナでは23種類の
ARF遺伝子が発見されている。オーキシンに応答して発現を変化させる遺伝子の上流域にはオーキシン応答配列(auxin response element:AuxRE)と呼ばれる塩基配列があり、ARFタンパク質はこのAuxREに結合して、遺伝子発現の活性化や抑制化を行う。
[17] 転写因子、マスターレギュレーター
転写因子は特定のDNA配列に結合し、遺伝子発現を制御するタンパク質の一群。遺伝子発現のスイッチに例えられ、遺伝子発現を促進するものを転写活性化因子、抑えるものを転写抑制因子と呼ぶ。マスターレギュレーターとは、そのような転写因子の中で、下流にある多数の遺伝子の発現を一括して制御する役割を持つものを指す。
[18] MYB3R4
R1R2R3-Myb型タンパク質である転写因子の一種。類似の転写因子であるMYB3R1とともに、細胞周期のうち分裂直前期および分裂期に相当するG2/M期に特異的に発現するさまざまな遺伝子の発現活性化を担っている。MYB3R4およびMYB3R1の両方を欠損したシロイヌナズナ変異体では、mitosis-specific activator(MSA)モチーフと呼ばれる塩基配列を上流域に持つ遺伝子の多くが発現できなくなっていることから、MYB3R4はMYB3R1とともにこのMSAを通してG2/M期特異的な遺伝子発現を制御していると考えられている。
[19] 持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
【国際共同研究グループ】
理化学研究所 環境資源科学研究センター細胞機能研究チーム
研修生 坂本 優希 (サカモト・ユウキ)
(東京大学 大学院理学系研究科 博士課程)
テクニカルスタッフⅡ 河村 彩子 (カワムラ・アヤコ)
チームリーダー 杉本 慶子 (スギモト・ケイコ)
(東京大 学大学院理学系研究科 教授)
中部大学 応用生物学部
教授 鈴木 孝征 (スズキ・タカマサ)
教授 前島 正義 (マエシマ・マサヨシ)
基礎生物学研究所 生物進化研究部門
助教 瀬上 紹嗣 (セガミ・ショウジ)
VIB-UGent植物システムズバイオロジーセンター
博士課程学生(当時) ステファニー・ポリン (Stefanie Polyn)
グループリーダー リーベン・デ・ヴイールダー (Lieven De Veyder)
(ゲント大学 教授)
【研究支援】
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「植物の器官再生を制御する分子機構(研究代表者:杉本慶子)」、同学術変革領域研究(A)「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」の研究課題「植物の環境レジリエンスを支える傷害修復機構(研究代表者:杉本慶子)」、同特別研究員奨励費「シロイヌナズナ葉肉プロトプラストを用いた細胞の分化可塑性の機構解析(研究代表者:坂本優希)」による支援を受けて行われました。
【発表者・機関窓口】
<発表者> ※研究内容については発表者にお問い合わせください。
理化学研究所 環境資源科学研究センター 細胞機能研究チーム
研修生 坂本 優希 (サカモト・ユウキ)
(東京大学 大学院理学系研究科 博士課程)
チームリーダー 杉本 慶子 (スギモト・ケイコ)
(東京大学 大学院理学系研究科 教授)
中部大学 応用生物学部
教授 鈴木 孝征 (スズキ・タカマサ)
教授 前島 正義 (マエシマ・マサヨシ)
基礎生物学研究所 生物進化研究部門
助教 瀬上 紹嗣 (セガミ・ショウジ)
<機関窓口>
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
東京大学 大学院理学研究科・理学部 広報室 報道担当
E-mail:kouhou.s[at]gs.mail.u-tokyo.ac.jp
中部大学 学園広報部広報課 報道担当
E-mail:cuinfo[at]office.chubu.ac.jp
基礎生物学研究所 広報室 報道担当
E-mail:press[at]nibb.ac.jp
※上記の[at]は@に置き換えてください。





 図1 分化した体細胞がリプログラミングし、細胞増殖を繰り返して植物個体を再生するまでの過程
図1 分化した体細胞がリプログラミングし、細胞増殖を繰り返して植物個体を再生するまでの過程 図2 分化細胞からのリプログラミングに対するヒストンアセチル基転移酵素の阻害の影響
図2 分化細胞からのリプログラミングに対するヒストンアセチル基転移酵素の阻害の影響 図3ヒストンのアセチル化を介した分化細胞のリプログラミングの仕組み
図3ヒストンのアセチル化を介した分化細胞のリプログラミングの仕組み