真核生物の細胞の中には、一重の膜で囲まれた様々な内膜系オルガネラが存在します。それぞれのオルガネラには特有のタンパク質のセットが存在しており、細胞分化や発生、環境応答などにおいて重要な役割を果たしています。また、真核生物の中には独自のオルガネラを持つものが存在します。真核生物の祖先は、内膜系オルガネラをもたない原核生物の古細菌の一種に似ていたと考えられていますが、そこから現存の真核生物の複雑な内膜系オルガネラがどのようにできてきたのかは分かっていません。
基礎生物学研究所 細胞動態研究部門の金澤建彦助教、上田貴志教授らと、同研究所 生物機能情報分析室、東京大学大学院理学系研究科、千葉大学大学院園芸学研究科、京都大学大学院生命科学研究科、理化学研究所 光量子光学研究センターで構成される研究グループは、コケ植物苔類に属するゼニゴケにおいて、細胞質分裂時に一時的に出現する「細胞板」
注と苔類に特有のオルガネラである「油体」がともに分泌経路(細胞の中からの外方向への輸送経路)の方向を転換することにより形成されることを発見しました(図1)。また、約5万のゼニゴケ変異体の解析から油体を作るマスター制御因子であるMpERF13を見いだしました。さらに、MpERF13の改変により油体の数を変化させたゼニゴケとオカダンゴムシを使った被食テストにより、ゼニゴケの油体が動物からの食害防御にはたらいていることも明らかにしました。本研究の結果は、植物の異なる機能を持つオルガネラや細胞構造が周期的な分泌経路の方向性の切り換えにより獲得されたことを示しています。これにより、進化の過程におけるオルガネラ獲得機構の一端が明らかになりました。本研究成果は、日本時間2020年12月1日19時に英国の科学雑誌
Nature Communicationsに掲載されます。
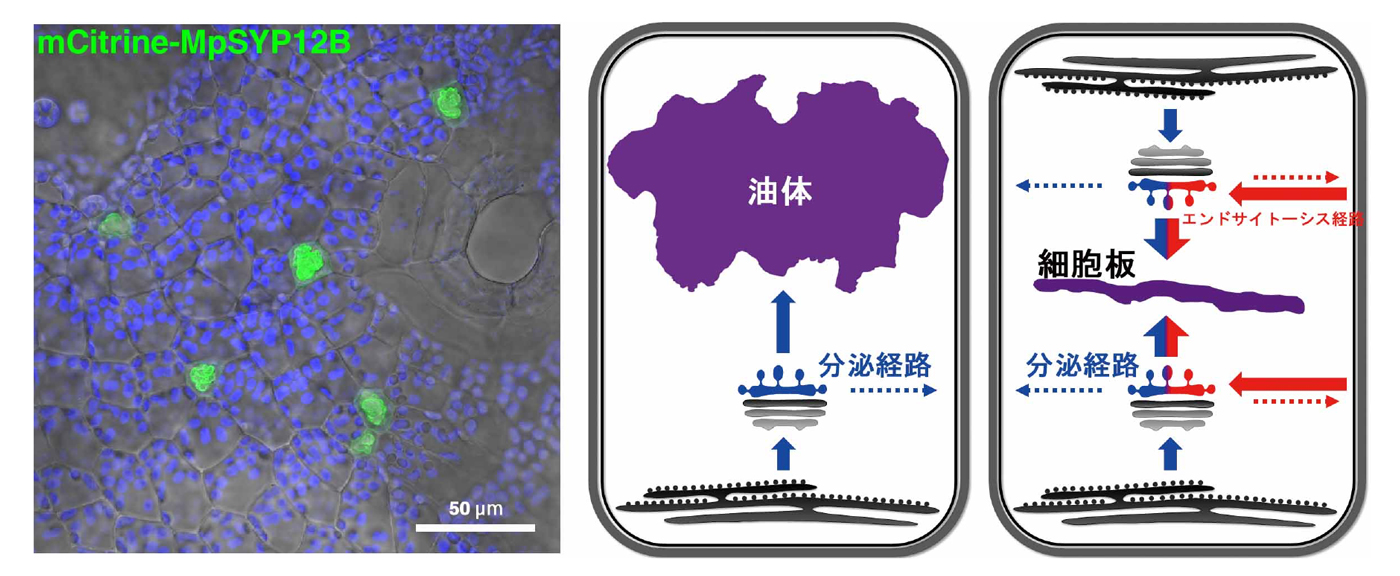 図1. 分泌経路の方向転換によりつくられる「油体」と「細胞板」
図1. 分泌経路の方向転換によりつくられる「油体」と「細胞板」
ゼニゴケの葉状体(葉のように見える構造)に存在する油体(左図、緑色に表示)と、油体と細胞板の形成機構の模式図(右図)。油体も細胞板もともに、通常は細胞の外方向に向いている分泌経路の方向(青矢印)を細胞の内方向へと転換することで形成されることがわかった。なお、細胞板の形成にはエンドサイトーシス経路(赤矢印)も関わることが明らかにされている。
注:細胞板は、陸上植物の細胞が分裂する際に細胞質を二分するために形成される構造。植物の細胞は強固な細胞壁をもつため、動物細胞のように収縮環のような構造で細胞をくびり切ることが出来ない。そのため、細胞の中に将来細胞の外になる円盤状の空間(細胞板)を構築し、それを外側に向かって拡大させて最終的に母細胞の細胞壁と融合させることで細胞質分裂を行う(図1右図も参照)。
【研究の背景】
真核生物の細胞内には、ゴルジ体や液胞・リソソームといった一重の膜で囲まれたオルガネラ(細胞小器官)が存在します。これらのオルガネラには、それぞれの機能発現に必要な様々なタンパク質や脂質、多糖類が局在しています。これらの物質の正しい局在化や輸送を実現する仕組みが「膜交通」です。膜交通とは、オルガネラの間で、膜で出来た小胞や小管を介して物質をやり取りする仕組みです。ここで、進化の過程で新しいオルガネラが出来る過程について考えてみます。新しいオルガネラの誕生は、そのオルガネラと既存のオルガネラを結ぶ新しい膜交通経路の開拓をともなったはずです。
オルガネラの新生と膜交通経路の新規開拓の仕組みを説明する仮説として、比較ゲノム解析の結果をもとにオルガネラパラロジー仮説(Organelle paralogy hypothesis)が提唱されています。この仮説では、膜交通の実行因子をコードする遺伝子が遺伝子重複と変異の蓄積を通して機能分化し、その結果新たなオルガネラとそのオルガネラを発着する膜交通経路が誕生したとされています。つまり、単膜系オルガネラ同士は共通の祖先オルガネラから派生したパラロガスな関係にあるというのです。しかし、オルガネラパラロジー仮説を実験的な証拠をもって支持した研究の例はほとんどありません。
陸上植物では、細胞質分裂時に娘核の間の分裂面に分泌小胞を輸送し、この分泌小胞同士が融合することで「細胞板」が形成されます。また、コケ植物苔類には、「油体」と呼ばれる苔類特有のオルガネラが存在します。これらのオルガネラは、真核生物の一部の系統で新しく獲得されたオルガネラの好例です。本研究では、この二つの全く異なるはたらきを持つオルガネラが共通の仕組みにより形成されることを明らかにし、オルガネラパラロジー仮説を強く支持する結果を得ました。
【研究の成果】
本研究のハイライトは、細胞板と油体という全く異なるオルガネラ/細胞構造への物質輸送に、分泌経路を細胞内方向へと方向転換するという共通の仕組みがはたらいていることを発見した点です。さらに、油体形成を司るマスター制御転写因子MpERF13を発見し、植物のオルガネラ獲得機構と転写調節が深く関わっていることも明らかにしました。
分泌経路は、細胞内のオルガネラから、細胞膜や細胞外へ物質を輸送する膜交通経路です。植物の分泌経路ではたらくタンパク質の一つに、SYP1があります。SYP1は動物のSyntaxin 1のホモログであり、主に細胞膜上に局在し、分泌小胞と細胞膜の融合を実行する因子です。このSYP1自身も小胞体上で合成された後、分泌経路の積み荷タンパク質として、目的地である細胞膜まで輸送されます。本研究ではまず、ゼニゴケに4つあるSYP1メンバー(MpSYP12A、MpSYP12B、MpSYP13A、MpSYP13B)について、発現している場所と細胞内局在を調べました。
その結果、MpSYP12Aは、細胞膜上に存在するほか、細胞分裂の際には形成中の細胞板に局在することがわかりました(図2-1)。また、MpSYP12Aの機能を失った変異体では、細胞質分裂が異常になることから、MpSYP12Aが細胞板形成に重要な役割を果たしていることを見出しました(図2-2)。
さらに研究グループは、MpSYP12Aが細胞板に局在する仕組みを調べ、Mp
SYP12A遺伝子の遺伝子発現調節領域が、細胞板への局在に重要であることを発見しました。他のSYP1メンバーについても、MpSYP12Aの遺伝子発現調節領域制御下で発現すると細胞板に局在することが分かりました。この結果は、細胞板を作る際に分泌経路の方向が細胞膜方向から細胞板方向へと切りかわっていることを示しており、シロイヌナズナ等他の植物の知見と合わせ、細胞板への物質輸送の仕組みが陸上植物の間で保存されていることが分かりました。
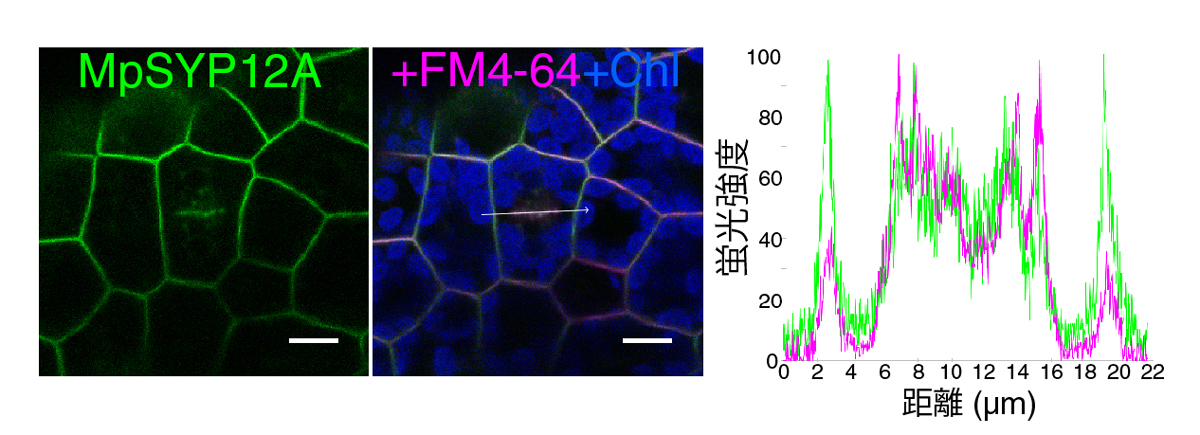
図2-1. MpSYP12Aは細胞膜上と細胞板に局在する
MpSYP12Aは細胞膜上に存在するほか、細胞質分裂時に出現する「細胞板」に局在する。
スケールバーは10 μm。
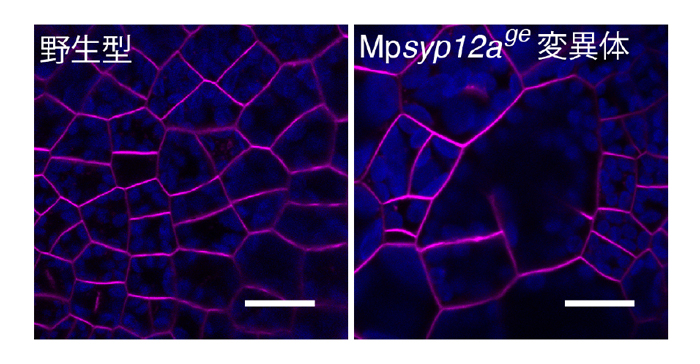
図2-2. MpSYP12Aは細胞板形成に重要な役割を果たす
Mpsyp12a変異体では細胞質分裂が異常になる(右)。スケールバーは10 μm。
一方、MpSYP12Aと非常によく似た構造を持つパラログであるMpSYP12Bは、他のSYP1メンバーと異なり、油体を含む油体細胞のみで発現し、油体膜に局在することがわかりました(図3)。油体は180年以上前の1834年に出版された文献に既に記載が見られ、シュライデン(1838)とシュワン(1839)による細胞説の提唱の前に見つけられていた数少ないオルガネラのひとつです。しかしながら、油体の起源については諸説紛々の状態が続いていました。
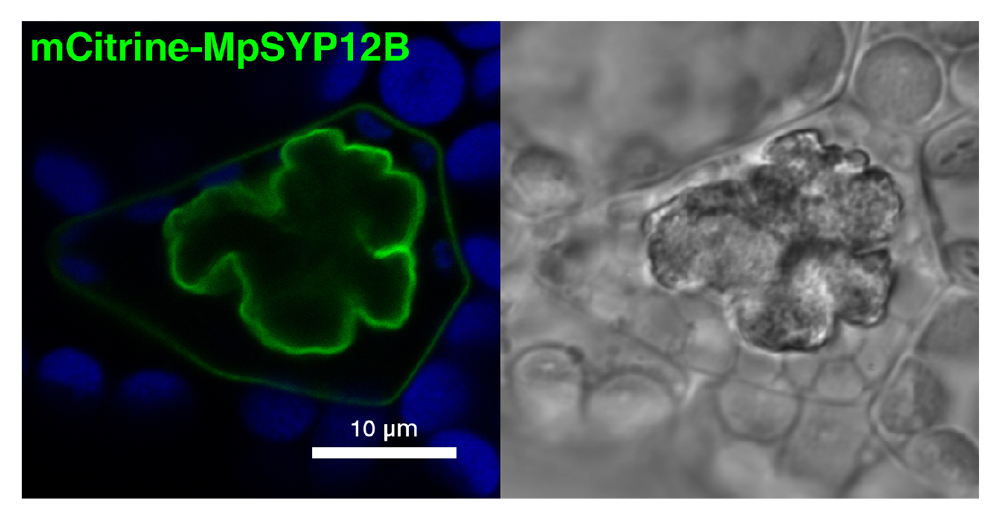
図3. MpSYP12Bは油体膜に局在する
研究グループは、ゼニゴケの油体がどのような性質をもつのかを、電子顕微鏡観察や様々なオルガネラマーカーを用いた共焦点顕微鏡観察により詳細に調べました。その結果、細胞膜タンパク質の中に油体膜にも局在するものがあること、油体膜からクラスリン被覆小胞が形成されること、分泌のマーカータンパク質が油体内腔にも輸送されることを見出しました。
続いて、MpSYP12Bがどのようにして油体に局在するのか、その仕組みを調べました。その結果、Mp
SYP12B遺伝子の遺伝子発現調節領域が油体への局在に重要であることを発見しました。また、通常は細胞膜と油体膜に局在するタンパク質(MpPIP2とMpSYP13A)をMpSYP12Bの遺伝子発現調節領域の制御下で発現したところ、ほぼ油体膜のみに局在するようになることが分かりました(図4)。これらの結果は、油体を作る際には、分泌経路の方向が細胞膜方向から油体方向へと切りかわっていることを示しています。
また、油体の形成過程を観察することで、油体は細胞の生長過程において限られた時期にのみ形成されるのではなく、油体細胞の生長に伴って油体の大きさも徐々に増加することが分かりました。よって、細胞膜方向から油体方向への分泌経路の方向転換が、細胞の生長過程において何度も繰り返して起こる周期的な現象であることが示唆されました。研究グループはこの周期的な分泌経路の方向性の切り替えによる油体の発生の仕組みを「油体周期」と命名し、提唱しました。
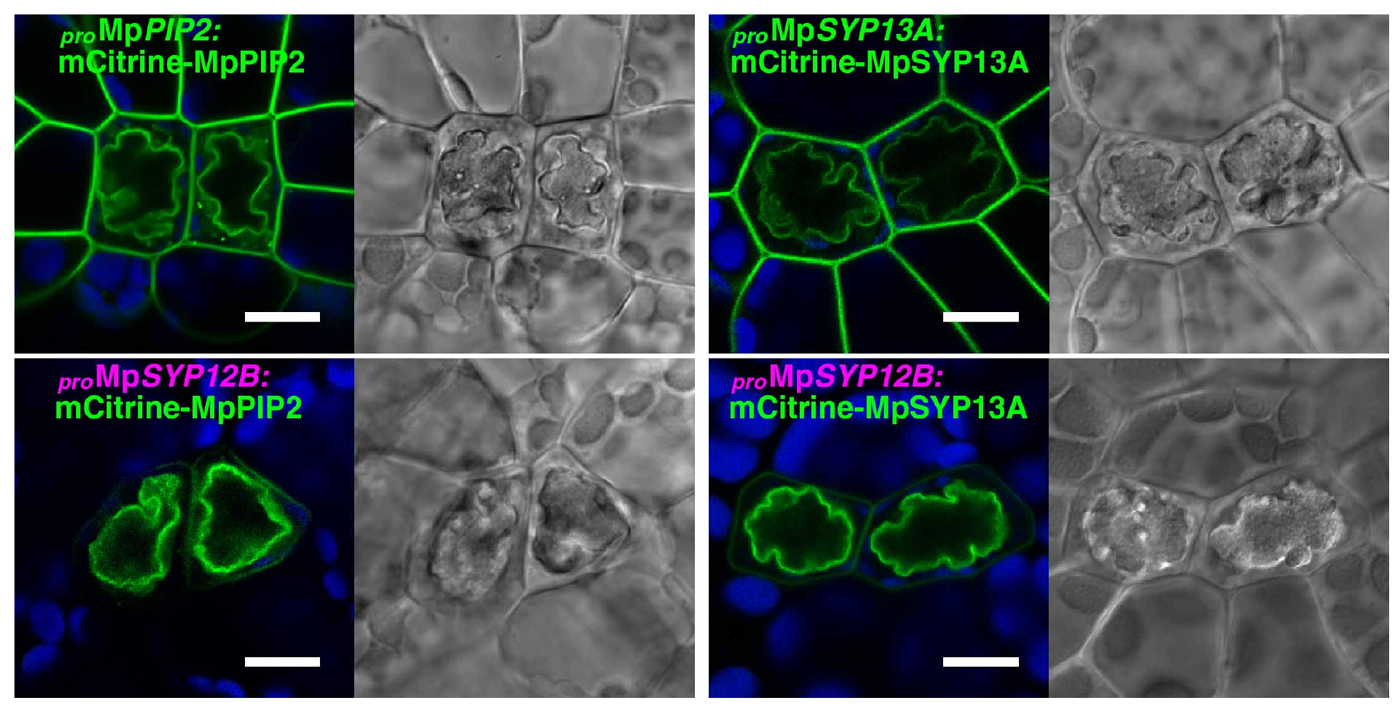
図4. 油体は分泌経路を細胞内に方向転換することでつくられる
通常は細胞膜と油体膜の両方に局在するタンパク質(MpPIP2とMpSYP13Aに黄色蛍光タンパク質mCitrineを融合したもの)をMpSYP12Bの遺伝子発現調節領域の制御下で発現させると、主に油体膜に局在するようになる。スケールバーは10 μm。
遺伝子発現調節領域を交換することでタンパク質の輸送先が細胞膜から油体膜へと変わることから、油体周期は転写レベルで制御されていると考えられました。そこで、油体が過剰に形成される変異体を約5万の変異体候補の中から選抜し、その責任遺伝子の解析を行うことで、油体形成のマスター制御転写因子であるMpERF13を発見することに成功しました。MpERF13の過剰発現変異体では油体形成が亢進しますが、機能欠損変異体では油体が全くつくられなくなります(図5)。さらにこれらの変異体を用いたRNA-Seq解析を行い、油体形成に関与する遺伝子群を網羅的に同定することにも成功しました。
油体には生理活性の高い多くの化合物が含まれていることが分かっていましたが、その生物学的な役割は未解明でした。そこで、MpERF13を用いて油体を過剰形成した変異体と油体が全くない変異体とを基礎生物学研究所の周辺に生息しているオカダンゴムシに食べさせる実験を行い、油体が被食に対する防御に関わる可能性を検証しました。その結果、油体を過剰形成する変異体にはオカダンゴムシはほとんど寄りつかず、野生型のゼニゴケもほとんど無傷のまま残ったのに対し、油体を持たないゼニゴケ変異体はオカダンゴムシに食べられてしまうことが分かりました(図5、動画)。この結果は、油体が捕食者からの防御に役立つことを示しています。
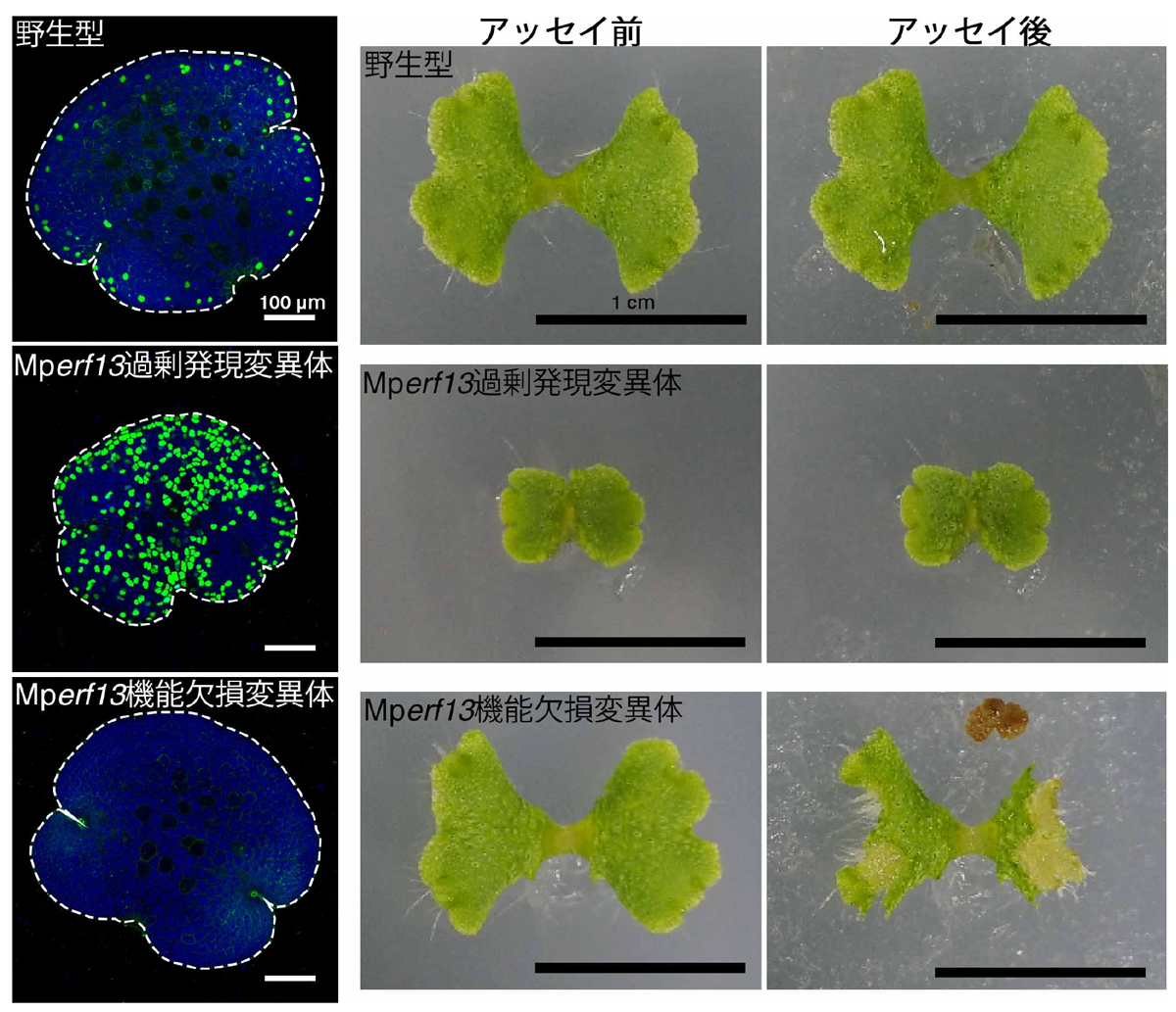 図5. 油体は捕食者からの防御に重要な役割を果たす
図5. 油体は捕食者からの防御に重要な役割を果たす
左図は油体を緑色に光る蛍光色素で染色したもの。油体形成のマスター制御転写因子MpERF13の過剰発現変異体では油体が異所的に形成され、機能欠損変異体では油体が全く形成されない。オカダンゴムシを用いた被食アッセイ(右図)では、油体を持たない変異体が多く被食される。
動画. オカダンゴムシを用いた被食アッセイ
【まとめと今後の展望】
今回の研究から、油体と細胞板という全く機能の異なるオルガネラ・細胞構造が、細胞状態の変化に応じて分泌経路の方向性を細胞外方向から細胞内方向へと転換することにより形成されることが明らかになりました。それぞれの輸送経路でよく似たSYP1メンバーがはたらいているという結果は、オルガネラパラロジー仮説が提唱する膜交通の鍵因子の遺伝子重複による数の増加とその後の機能分化が新しいオルガネラの獲得に繋がるという仮説を強く支持します。今後分泌経路の方向転換の仕組みをさらに詳しく調べることで、新規オルガネラ獲得のメカニズムのさらなる解明につながることが期待されます。
一方、油体は生理活性の高い種々の化合物を蓄積しており、その中には、抗菌作用や抗ガン活性、2009年にパンデミックを起こした新型インフルエンザを含むA型インフルエンザに対する抗ウイルス活性を持つことが報告されているものも含まれています。本研究で明らかにした油体形成の仕組みや油体形成に関わる遺伝子群を活用すれば、それらの有用化合物の効率的な産生にも役立つかもしれません。
【発表雑誌】
雑誌名: Nature Communications
掲載日: 日本時間2020年12月1日19時
論文タイトル: The liverwort oil body is formed by redirection of the secretory pathway
著者: Takehiko Kanazawa, Hatsune Morinaka, Kazuo Ebine, Takashi L. Shimada, Sakiko Ishida, Naoki Minamino, Katsushi Yamaguchi, Shuji Shigenobu, Takayuki Kohchi, Akihiko Nakano, and Takashi Ueda
DOI:
https://doi.org/10.1038/s41467-020-19978-1
【研究グループ】
本研究は、基礎生物学研究所 細胞動態研究部門、同研究所 生物機能情報分析、東京大学大学院理学系研究科、千葉大学大学院園芸学研究科、京都大学大学院生命科学研究科、理化学研究所 光量子光学研究センターが参加した共同研究チームにより実施されました。
【研究サポート】
本研究は、科学研究費助成事業(19H05670, 19H05675, 18H02470, 18K14738, 20K15825)の支援を受けて行われました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 細胞動態研究部門
教授 上田 貴志(うえだ たかし)
TEL: 0564-55-7530
E-mail: tueda@nibb.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp





 図1. 分泌経路の方向転換によりつくられる「油体」と「細胞板」
図1. 分泌経路の方向転換によりつくられる「油体」と「細胞板」



 図5. 油体は捕食者からの防御に重要な役割を果たす
図5. 油体は捕食者からの防御に重要な役割を果たす