
基礎生物学研究所



2018.01.11
早稲田大学
沖縄科学技術大学院大学(OIST)
基礎生物学研究所
早稲田大学理工学術院の胡桃坂仁志(くるみざかひとし)教授と町田晋一(まちだしんいち)研究院助教、沖縄科学技術大学院大学のマティアス・ウォルフ准教授と滝沢由政(たきざわよしまさ)博士らの研究グループは、基礎生物学研究所の中山潤一(なかやまじゅんいち)教授と共同で、不活性化した染色体領域であるヘテロクロマチンの基盤構造を、最新のクライオ電子顕微鏡法の技術によって世界で初めて明らかにしました。
2017年にクライオ電子顕微鏡法の開発にノーベル化学賞が授与されましたが、日本ではこの技術による生体巨大分子の構造解析研究が立ち遅れています。今回の研究成果は、世界に先駆けて、染色体の遺伝子不活性化領域である”ヘテロクロマチン“の基盤構造を解明したものであり、染色体不活性化の不全による発がんや感染症の原因解明にも重要な一歩です。また本研究は、日本が立ち遅れているクライオ電子顕微鏡法によって成し遂げた成果でもあり、国際的に日本のプレゼンスを示す重要な成果です。
真核生物の遺伝情報であるゲノムDNAは、ヒストンと呼ばれるタンパク質との複合体として存在しており、コンパクトに折りたたまれて細胞核の中に収納されています。その折りたたまれ方の違いによって、ゲノムDNAの読み取りがオン(活性化)になったりオフ(不活性化)になったりする領域が作られています。本研究は、ヒト染色体で遺伝子が恒常的にオフになっているヘテロクロマチンの基盤構造を世界に先駆けて解明しました。ヘテロクロマチンにおける恒常的な遺伝子オフの破綻が、ある種の「がん」や「感染症」などを引き起こす原因となると考えられており、これらの疾病の発症機構の理解のみならず、これらをターゲットとした創薬研究に対しても重要な基盤情報を提供しています。
本研究成果は、2018年1月11日正午(現地時間)発行の米国科学誌『Molecular Cell』オンライン版に掲載(紙面掲載は2月1日(現地時間))されました。
(1)これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
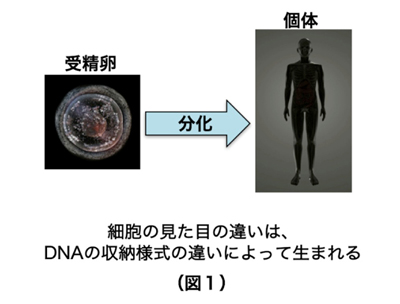
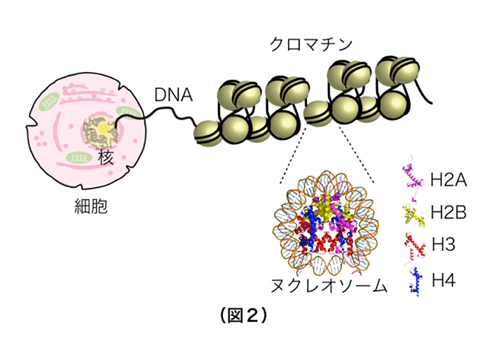
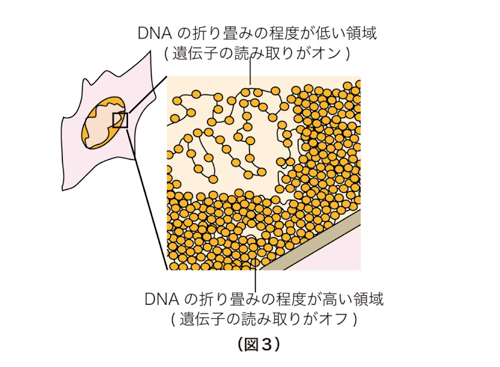
ヒトは様々な種類の細胞から構成されています。もとをたどると、1つの受精卵が様々な細胞に分化して特化した細胞集団となることで、皮膚、肝臓、心臓、脳といった組織が形成されています (図1)。細胞の分化と組織形成は、それぞれの細胞の中で必要な遺伝子が選択的に読み取られることによって成し遂げられています。しかし、ヒトを構成するそれぞれの細胞は同一の遺伝情報(ゲノムDNA配列)を有しているため、皮膚では皮膚を作るために必要な遺伝子群のみを、肝臓では肝臓を作るために必要な遺伝子群のみをオンにして、不要な遺伝子群をすべてオフにしておく必要があります。真核生物のゲノムDNAは、ヒストンタンパク質群に巻き付けられてヌクレオソームと呼ばれる安定な構造体を作り、このヌクレオソームが数珠状に連なることでクロマチン構造が形成されています。ヒストンにはH2A、H2B、H3、H4の4種類が存在し、それぞれのヒストンが様々な化学修飾を受けることで、特徴的なクロマチン構造が形成されます(図2)。効率良くゲノム中のDNA群をオフにするために、生物はオフにすべきゲノム領域のDNAを、読み取り不可能な形で折りたたんでいることが、近年明らかになってきました(図3)。この読み取り不可能なゲノム領域が、“ヘテロクロマチン”と呼ばれる特殊なクロマチン構造です。
このようなクロマチンの構造変換には、ヒストン自身に施される化学修飾が重要な役割を果たしていることが近年明らかにされてきました。ヘテロクロマチンでは、ヒストンH3の9番目のリジンがトリメチル化修飾(H3K9me3)を受けています。ヘテロクロマチンの主要な構成因子であるHP1と呼ばれるタンパク質は、H3K9me3を含むクロマチンに結合し、ヘテロクロマチンの基盤となる構造を形成します。ヘテロクロマチンの基盤構造を解明するために、これまでに、HP1タンパク質がどのようにH3K9me3を含むクロマチンに結合するのかに関して、世界中で膨大な研究がなされてきましたが、実際にどのような構造なのか、その詳細は不明でした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
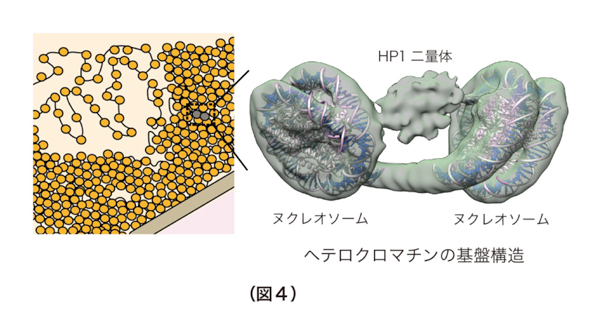
今回本研究グループは、HP1とH3K9me3を含むクロマチンで形成されるヘテロクロマチンの基盤構造を解明することを目指しました。具体的には、ヒトのHP1と2つのヌクレオソームが連結されたダイヌクレオソームとの複合体を、H3K9me3を模倣したヒストンを用いて試験管内で再構成し、最新のクライオ電子顕微鏡法により、その立体構造を明らかにすることに世界で初めて成功しました(図4)。本研究により、HP1は2つのヌクレオソームを架橋する形でH3K9me3を含んだヌクレオソームに結合することで、ヘテロクロマチンの基盤構造を形成していることが明らかになりました。
(3)そのために新しく開発した手法
本研究グループは、ヒトのHP1が結合したダイヌクレオソームを試験管内で再構成し、高純度かつ安定に精製する手法を独自に開発しました。この技術によって、高純度に精製された状態で、HP1-ダイヌクレオソーム複合体サンプルを作製することが可能になりました。本技術と、最新のクライオ電子顕微鏡解析手法を組み合わせることによって、HP1-ダイヌクレオソーム複合体群の立体構造を明らかにすることができました。
(4)今回の研究で得られた結果及び知見
これまでに、ヘテロクロマチンはHP1とH3K9me3を含むヌクレオソームとの複合体を基盤として形成されているとわかっていましたが、その立体構造に関しては明らかにされていませんでした。本研究により、HP1とH3K9me3を含むヘテロクロマチンの立体構造基盤が明らかになりました。その立体構造から得られた知見として、HP1が隣り合った2つのヌクレオソームをブリッジした状態でクロマチンに結合していることが明らかになりました。この発見により、永年の論争であった「ヘテロクロマチンにおけるHP1の結合様式」に最終的な結論を与えることができました。また、多数のヘテロクロマチン構成因子がHP1やリンカーDNAに結合することが知られていましたが、HP1-クロマチン複合体中のHP1およびリンカーDNAは、それらヘテロクロマチン構成因子の結合の足場となることが可能な状態であることが明らかになりました。
(5)研究の波及効果や社会的影響
高度に凝縮したヘテロクロマチンは、今から約90年前に顕微鏡観察によって観察された最も特徴的なクロマチン領域ですが、その実体は明らかになっていませんでした。今回、本研究グループは、ヘテロクロマチンの基盤であるHP1とH3K9me3を含むクロマチンの立体構造を、最新のクライオ電子顕微鏡法によって解明しました。この発見は、ヘテロクロマチンにおける遺伝子オフ機構の解明への重要な足がかりになると考えられます。また、ヘテロクロマチンの破綻が染色体異常や腫瘍化リスクを上昇させることが報告されています(参考文献1)。さらに、HIVなどのウイルス感染がヘテロクロマチンと密接に関係していることもわかっています(参考文献2)。これらのことから、ヘテロクロマチンの基盤構造の解明は、癌やウイルス感染をターゲットとした創薬研究において、重要な基盤情報となると考えられます。
(6)今後の課題
今回、世界で初めてヘテロクロマチンの基盤構造を、HP1タンパク質とヌクレオソームニ量体のレベルで解明しました。実際のヘテロクロマチンでは、この基盤構造が連続してさらに高次の構造体を形成していると考えられます。そのような高次のヘテロクロマチンでは、HP1およびリンカーDNAに結合するタンパク質群が加わった巨大なクロマチン複合体を形成していると考えられています。今回の研究によって確立した手法および得られた結果をもとに、さらに高次元のヘテロクロマチンの立体構造を解明し、ゲノムにおける遺伝子オン・オフの制御機構の詳細が明らかになっていくことが期待されます。
【参考文献】
1. Peters A. H. et al., Cell, 2001.
2. Chéné I.D. et al., EMBO J., 2007
【論文情報】
・掲載誌:Molecular Cell
・論文名:Structural Basis of Heterochromatin Formation by Human HP1
・著者 :Shinichi Machida(早大), Yoshimasa Takizawa(OIST), Masakazu Ishimaru(早大), Yukihiko Sugita(OIST), Satoshi Sekine(早大), Jun-ichi Nakayama(基生研), Matthias Wolf(OIST), Hitoshi Kurumizaka(早大)
【研究内容に関するお問い合わせ先】
早稲田大学理工学術院 胡桃坂仁志
TEL: 03-5369-7315 E-mail: kurumizaka@waseda.jp
【発信元】
早稲田大学広報室広報課
電話:03-3202-5454 E-mail:koho@list.waseda.jp
沖縄科学技術大学院大学(OIST)広報 メディアセクション
電話: 098-982-3447 E-mail: media@oist.jp
基礎生物学研究所 広報室
電話:0564-55-7628 E-mail: press@nibb.ac.jp