
基礎生物学研究所




2017.11.21
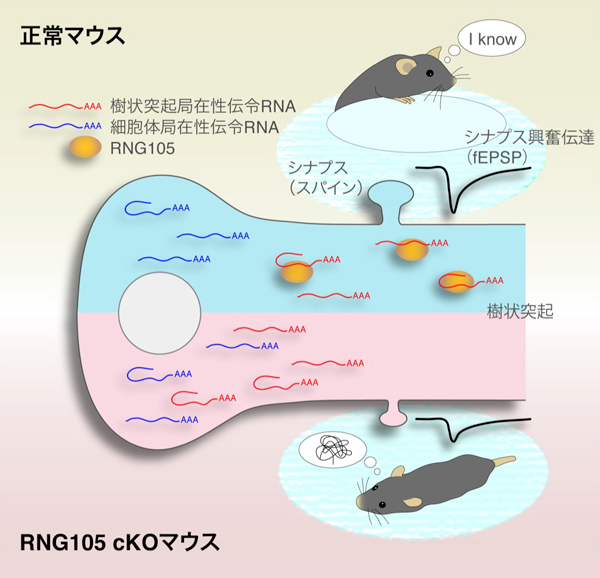
基礎生物学研究所/岡崎統合バイオサイエンスセンター 神経細胞生物学研究室の中山啓助教、大橋りえ大学院生(総合研究大学院大学)、椎名伸之准教授らの研究グループは、新潟大学(崎村建司教授)、東京理科大学(古市貞一教授)、東京薬科大学(篠田陽講師)、基礎生物学研究所(野田昌晴教授、重信秀治准教授)、神戸市看護大学(二木啓教授)、理化学研究所(御子柴克彦チームリーダー)の研究グループと共同で、長期記憶の形成のためには、タンパク質の設計図である「伝令RNA」を、神経細胞から長く伸びた樹状突起へ局在化させる因子、RNG105が必須であることを明らかにしました。
我々が物事を覚える際に、数時間、数日間、あるいは数年間という長期に渡る記憶を形成するためには、脳内でのタンパク質合成が不可欠であることが知られています。しかし、そのタンパク質合成の分子メカニズムは四半世紀に渡って未解明の問題として残されていました。神経細胞におけるタンパク質合成には、細胞全体で起こる一般的な制御と、神経細胞間の興奮伝達を仲介する樹状突起上のシナプスの近傍でのみ起こる局所的な制御とが存在します。本研究では、後者の局所的制御に関わる因子「RNG105」に着目し、マウスを用いて、RNG105の欠損が長期記憶や伝令RNAに及ぼす影響について解析を行いました。その結果、RNG105欠損マウスでは、特定の伝令RNAの樹状突起への局在化が低下し、長期記憶が著しく低下することが明らかになりました。これら特定の伝令RNAをもとに合成されるタンパク質には、シナプスでの興奮伝達を担う「AMPA受容体」を制御するタンパク質が多く含まれていました。RNG105欠損マウスでは、このAMPA受容体が上手く機能できず、シナプスを介した興奮伝達も著しく低下しました。以上の結果から、RNG105によって伝令RNAを樹状突起に局在化させ、その伝令RNAをもとにしてAMPA受容体制御タンパク質の合成を樹状突起上のシナプス近傍で起こすことが、シナプスの正常な興奮伝達、ひいては長期記憶の形成に不可欠であるという新たな分子メカニズムを提唱しました。
本研究成果は、2017年11月21日付けで英国オンライン科学誌eLifeに掲載されます。
【背景】
私たちの脳を構成する神経細胞(ニューロン)は、2種類の長い突起(軸索・樹状突起)を持ち、あるニューロンの軸索と異なるニューロンの樹状突起がシナプスと呼ばれるつなぎ目で結合しています(図1)。長期記憶の形成には、樹状突起上にある後シナプス(スパイン)を肥大させ、そこにAMPA受容体*1を増やすという「シナプス強化」が不可欠です(図1)。このシナプス強化のためには、樹状突起のスパイン近傍で「局所的タンパク質合成」が起こることが重要だと考えられています(図1)。局所的タンパク質合成が起こるためには、タンパク質合成の設計図である伝令RNAが、「RNA顆粒」と呼ばれる複合体により細胞体から樹状突起へと輸送されることが必要です(図1)。しかし、RNA顆粒の働きが実際に長期記憶に必要かどうかは、長年の間、未解明の問題として残されていました。
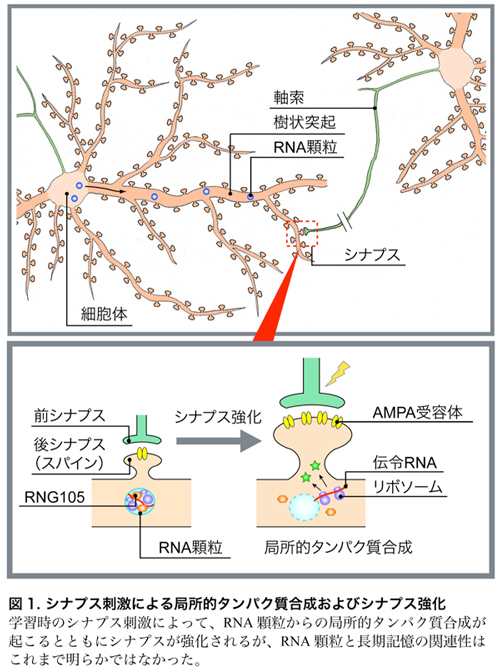
本研究では、RNA顆粒の主要な構成因子“RNG105”(別名Caprin1)に着目しました。これまで、RNG105を恒常的に欠損したマウスは生後まもなく死亡するため、成体マウスにおけるRNG105の機能は不明のままでした。そこで本研究では、RNG105を胎仔期後期以降、脳で欠損させたRNG105コンディショナル欠損 (cKO) マウスを作製し、成体マウスを得ることに成功しました。このマウスを用いて、RNG105が長期記憶に与える影響、およびその基盤となる分子メカニズムの解明を目指して研究を行いました。
【研究成果】
・RNG105コンディショナル欠損 (cKO) マウスでは長期記憶が低下する
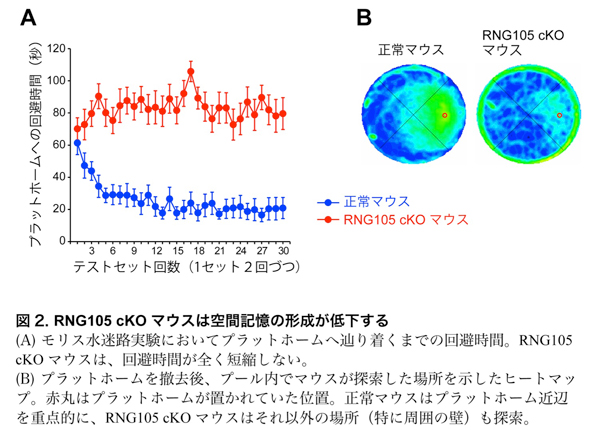
RNG105 cKOマウスの学習・記憶能力について、モリス水迷路テストおよび条件付け文脈学習テストにより測定を行いました。モリス水迷路テストは、円形プールの特定の場所にマウスが回避できるプラットホームを隠して置き、その回避場所を数日かけて覚える長期記憶テストです。正常マウスはテストを重ねるごとにプラットホームの位置を学習して記憶したのに対し、RNG105 cKOマウスはテスト回数を重ねてもほぼ全く記憶ができませんでした(図2)。
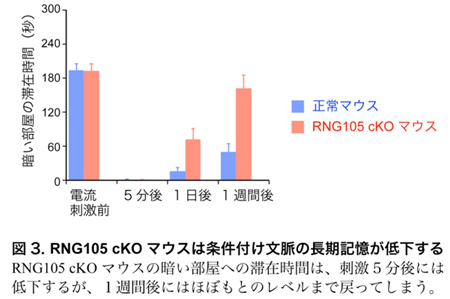
条件付け文脈学習テストでは、明るい部屋と暗い部屋とを自由に行き来できる装置を用います。通常、マウスは暗い場所を好み、そこに長く滞在します。しかし、暗い部屋に入った際に弱い電流を経験すると、マウスは嫌悪の経験を記憶し、その後は電流が流れなくても暗い部屋の滞在時間が減少します。この暗い部屋の滞在時間を計測した結果、RNG105 cKOマウスは5分間の短期記憶は正常に形成されるのに対し、1日から1週間に渡る長期記憶の形成は著しく障害されていることが明らかになりました(図3)。
・RNG105 cKOニューロンではシナプス強化 (スパイン肥大) が減弱する
RNG105 cKOのシナプス強化に対する影響を調べるために、興奮刺激を受けた際のスパインの肥大化(図1)を計測しました。正常ニューロンでは刺激によりスパインが肥大し、そのサイズは刺激後1時間経っても維持されました。一方、RNG105 cKOニューロンでは刺激によりスパインは一度肥大したものの、時間経過とともに次第に縮小しました(図4)。よって、RNG105は長期的なスパイン肥大化(シナプス強化)に必要であることが示されました。
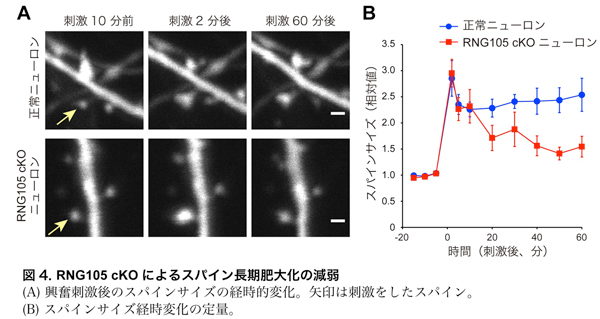
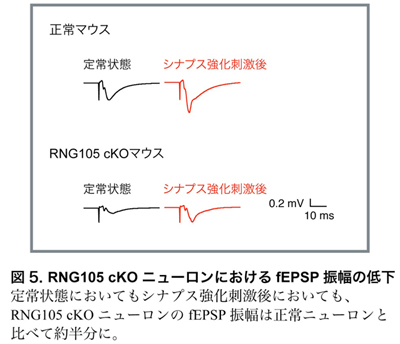
・RNG105 cKOニューロンではシナプス興奮伝達が低下する
次に、シナプス興奮伝達の指標となる興奮性シナプス後電位(fEPSP)の測定を行いました。その結果、RNG105 cKOマウスは正常マウスと比較し、fEPSPの大きさが約半分に低下しました(図5)。このことは、RNG105 cKOマウスでは、シナプスの興奮伝達を担うAMPA受容体が上手く機能できず、興奮伝達が低下していることを示しました。
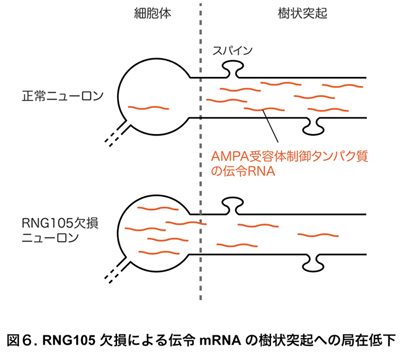
・RNG105 cKOニューロンでは樹状突起への伝令RNAの局在化が低下する
以上のようなRNG105 cKOマウスの表現型の基盤となる分子メカニズムを解明するため、RNG105 cKOが伝令RNAに及ぼす影響を解析しました。その結果、通常ではニューロンの樹状突起へ局在化する特定の伝令RNA群が、RNG105 cKOニューロンの樹状突起では局在化が低下していることを見出しました(図6)。そのような伝令RNA群の中には、AMPA受容体を制御するタンパク質の設計図である伝令RNAが多数含まれていました。以上のことから、RNG105 cKOニューロンでは、樹状突起上のスパイン付近へ本来供給されるべき伝令RNAが不足し、それをもとに合成されるAMPA受容体制御タンパク質もスパイン付近では不足していると考えられました。
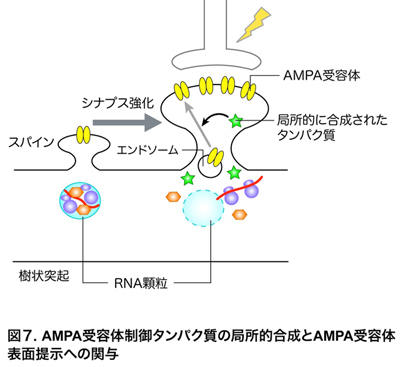
・RNG105の欠損は樹状突起におけるAMPA受容体の表面提示制御を低下させる
AMPA受容体制御タンパク質は、樹状突起内のエンドソームに隔離されたAMPA受容体を細胞表面に提示し、そこにつなぎ止めることによって、シナプス強化に関わることが知られています(図7)。そこで、AMPA受容体が樹状突起の表面にどのくらい提示されているかを定量解析しました。その結果、RNG105欠損ニューロンでは、樹状突起の表面にAMPA受容体を提示する制御機構が上手く機能せず、正常ニューロンに比べて表面のAMPA受容体が減少していることが明らかになりました。
以上の知見をまとめると、RNG105によって特定の伝令RNAが樹状突起に局在化し、樹状突起上のシナプス近傍でその伝令RNAをもとにしてAMPA受容体制御タンパク質を合成することが、シナプス強化、すなわち、スパインを肥大させてその表面に多くのAMPA受容体を提示させるのに必要だと考えられます。本研究は、このような分子メカニズムが、シナプス興奮伝達ひいては長期記憶の形成のために必要であるという新たなモデルを提唱しました。
【本研究の意義と今後の展開】
長期記憶形成にはタンパク質合成が必要であることが知られていたものの、両者をつなぐ分子メカニズムはこれまで明確に示されていませんでした。本研究は、RNA顆粒の構成因子であるRNG105が長期記憶の形成に不可欠であることを明らかにしました。さらに、その基盤となる分子メカニズムとして、RNG105は樹状突起への特定の伝令RNAの局在化を制御し、AMPA受容体の樹状突起における表面提示制御に関与することを示しました。
記憶は生物の生存や精神活動の基盤となる脳機能です。記憶の障害は様々な精神神経疾患とも関連しています。また、RNA顆粒の構成因子には、筋委縮性側索硬化症(ALS)等の神経変性疾患の他、精神遅滞症、自閉症スペクトラム(ASD)などの原因因子が数多く含まれています。RNG105の変異も、ASD様の行動を引き起こす原因の一つです。したがって、RNG105およびRNG105が樹状突起へ輸送する伝令RNA群は臨床的なマーカーや創薬のターゲットとなりうる可能性を有しており、本研究の成果は、記憶形成の分子メカニズムのさらなる解明に加え、臨床・創薬分野において役立つことが期待されます。
【用語説明】
*1AMPA受容体:興奮性神経伝達物質であるグルタミン酸の受容体の一種。中枢神経系のシナプス興奮伝達は主にこの受容体が担い、学習・記憶に必須の役割を果たしている。
【掲載紙情報】
eLife (2017年11月21日掲載予定)
論文タイトル: “RNG105/caprin1, an RNA granule protein for dendritic mRNA localization, is essential for long-term memory formation”
著者:Kei Nakayama*, Rie Ohashi*, Yo Shinoda, Maya Yamazaki, Manabu Abe, Akihiro Fujikawa, Shuji Shigenobu, Akira Futatsugi, Masaharu Noda, Katsuhiko Mikoshiba, Teiichi Furuichi, Kenji Sakimura, and Nobuyuki Shiina
(* These authors contributed equally.)
DOI: https://doi.org/10.7554/eLife.29677
【研究グループ】
本研究は、基礎生物学研究所/岡崎統合バイオサイエンスセンター 神経細胞生物学研究室の椎名伸之准教授、中山啓助教、大橋りえ大学院生を中心として、東京理科大学の古市貞一教授、篠田陽助教(現 東京薬科大学講師)、新潟大学の崎村建司教授、阿部学准教授、山崎真弥助教、基礎生物学研究所 統合神経生物学研究部門の野田昌晴教授、藤川顕寛博士、同研究所 生物機能情報分析室の重信秀治特任准教授、神戸市看護大学の二木啓教授、理化学研究所脳科学総合研究センターの御子柴克彦チームリーダーとの共同研究で行われました。
【研究サポート】
本研究は、文部科学省科学研究費助成事業(特定領域研究 統合脳 分子脳科学領域、基盤研究C)、上原記念生命科学財団、大幸財団、豊秋奨学会の支援のもと行われました。大橋りえ大学院生は日本学術振興会特別研究員(DC1)として本研究に従事しました。
【本研究に関するお問い合わせ先】
基礎生物学研究所/岡崎統合バイオサイエンスセンター
神経細胞生物学研究室
准教授:椎名 伸之(シイナ ノブユキ)
TEL:0564-55-7620
E-mail:nshiina@nibb.ac.jp
新潟大学脳研究所
細胞神経生物学分野
教授:﨑村 建司(サキムラ ケンジ)
TEL:025-227-0619
E-mail:sakimura@bri.niigata-u.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL:0564-55-7628
FAX:0564-55-7597
E-mail:press@nibb.ac.jp
新潟大学脳研究所 事務室
TEL:025-227-0565