
基礎生物学研究所




2017.09.14
【発表概要】
人や動物は、食べ過ぎると脂肪が増えて肥満します。レプチンは脂肪細胞から放出されるホルモンで、脳内の摂食中枢に作用して強力に摂食行動を抑制します。脂肪が増えるにしたがってレプチンの放出量が増えるため、レプチンは適正な体重の維持に働いていると考えられています。しかしながら、肥満状態の人の摂食は必ずしも抑制されていません。その理由は、レプチンが効きにくくなる、「レプチン抵抗性」と呼ばれる現象が起こるからです。レプチン抵抗性が生じるメカニズムはよく分かっておらず、その治療法も見つかっておりません。
今回、基礎生物学研究所・統合神経生物学研究部門の新谷隆史准教授、東覚大学院生、及び野田昌晴教授らは、PTPRJという酵素分子がレプチンの受容体の活性化を抑制していることを発見しました。肥満にともなって摂食中枢でPTPRJの発現が増えること、そのためにレプチンが効きにくくなり、これがレプチン抵抗性の要因となっていることを明らかにしました。
肥満は糖尿病、脂質異常症、高血圧などのメタボリックシンドロームの原因となるだけでなく、脂肪肝炎やがんなど、様々な疾患の発症に関わっています。本研究グループは以前に、PTPRJがインスリンの働きを抑制していることを明らかにしていました。インスリンの働きが悪くなると、糖尿病などの疾患を発症することが知られています。したがって、PTPRJの働きを抑制する薬剤は、インスリンとレプチンの働きを良くすることで、糖尿病とともに肥満を改善することができると考えられます。本研究成果は、9月14日にScientific Reportsにオンライン掲載されます。
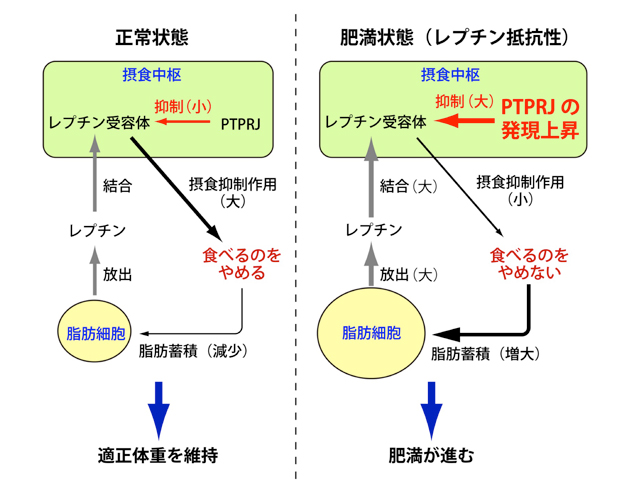
図 レプチン抵抗性形成のメカニズム
PTPRJはレプチン受容体に働いて、レプチンの働きを抑制しています。肥満すると摂食中枢でPTPRJの発現が増えます。この結果、レプチンが多くてもレプチンが効きにくくなり、これがレプチン抵抗性の要因となっていると考えられます。
【研究の背景】
レプチンは脂肪細胞から分泌されるホルモンであり、脳内の弓状核という摂食行動をコントロールしている領域(摂食中枢)に作用して、摂食を強力に抑制します。レプチンを遺伝的に欠いた人や動物は異常に肥満します。また、レプチン抵抗性を発症した人や動物にレプチンを投与しても、肥満を改善することはできません。レプチン抵抗性がどのようなメカニズムで生じるのかはよく分かっていませんでした。また、レプチン抵抗性を改善する薬剤は画期的な肥満薬になると考えられますが、未だ開発されておりません。
レプチンは細胞表面に存在するレプチン受容体に結合します。レプチン受容体にはJAK2というタンパク質リン酸化酵素が会合しています。レプチンが結合すると、JAK2は自身の特定のチロシン(タンパク質を作っているアミノ酸の一つ)を自己リン酸化することで活性化し、さらにレプチン受容体をリン酸化することによって細胞内へレプチンの情報を伝えます。この情報に従って、摂食中枢の神経細胞は摂食を抑制します。
統合神経生物学研究部門では、これまでに様々な受容体様タンパク質チロシン脱リン酸化酵素(RPTP)の生理機能を明らかにする研究を進めてきました。RPTPはタンパク質のチロシンに付いたリン酸をはずす(脱リン酸化する)酵素で、細胞表面に存在しています。2015年に研究グループは、RPTPの一つであるPTPRJが、インスリン受容体を脱リン酸化することによって、その働きを抑制していることを見出していました。PTPRJを欠損したマウスでは。食後の血糖値の上昇がおだやかで、インスリンの働きが増大していました。
【研究の成果】
PTPRJは脳の摂食中枢の神経細胞において高発現しています。研究グループは、Ptprjの遺伝子欠損マウス(Ptprjの発現を欠失したマウス)は正常に生育し、野生型マウス(正常なマウス)と比べて体長は変わりませんが、摂食量が少なく、低体重で脂肪量が少ないことを見出しました(図1)。またこれらのマウスにレプチンを投与すると、野生型マウスに比べて、Ptprj遺伝子欠損マウスでは、摂食量と体重が顕著に減少しました。Ptprj遺伝子欠損マウスではPTPRJが無いために、レプチンの摂食抑制の働きが強まっていると考えられました。研究グループはこのメカニズムを詳細に解析し、PTPRJがレプチン受容体に会合したJAK2を脱リン酸化することによって、レプチンの働きを抑制していることを明らかにしました。PTPRJがJAK2の活性化に重要な特定のチロシン残基を脱リン酸化しており、効率的にレプチン受容体の情報伝達を抑制していると考えられます。
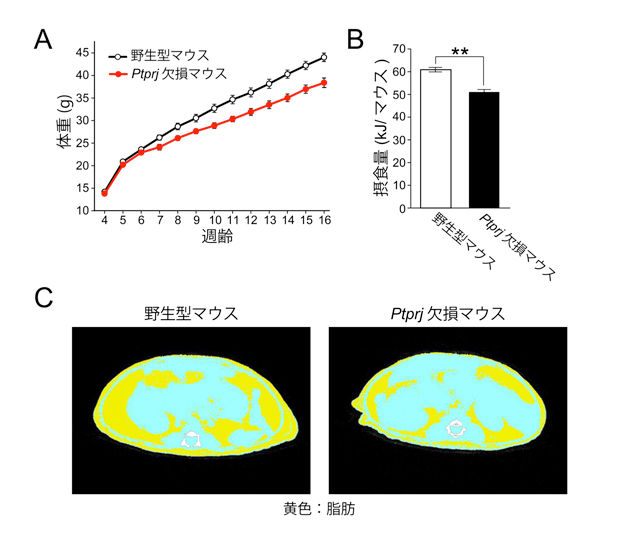
図1 高脂肪食で飼育した場合の野生型マウスとPtprj欠損マウスの比較
(A) 体重の推移。 (B) 12週齢における摂食量。(C) マウスの腹部断面のCT画像。野生型マウスに比べてPtprj欠損マウスにおいて脂肪(黄色)が顕著に少ないことが分かります。
マウスを高脂肪食で2か月間飼育すると、レプチン抵抗性が形成されることが知られています。この時、摂食中枢のPTPRJの発現が上昇していることがわかりました。次に、高脂肪食で長期間(14週間)飼育したマウスにレプチンを投与したところ、野生型マウスではレプチン抵抗性を発症しており摂食量と体重の減少がほとんど見られませんでした。一方、Ptprj遺伝子欠損マウスでは、レプチン投与に応答して摂食量及び体重の顕著な減少が見られ、レプチン抵抗性が生じないことが分かりました(図2)。さらに、レプチン抵抗性を発症していない野生型マウスの摂食中枢に人為的にPTPRJの発現を増加させると、レプチン抵抗性が誘導されました。
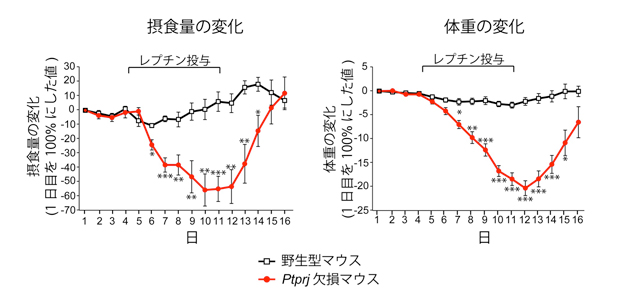
図2 高脂肪食で長期間飼育したマウスへのレプチン投与実験
野生型マウス(黒)にレプチンを投与しても摂食量及び体重の減少が見られない(レプチン抵抗性)のに対して、Ptprj欠損マウス(赤)では顕著な減少が見られます。
以上の結果から、肥満にともない弓状核でPTPRJの発現が上昇することが、レプチン抵抗性の要因となっていることが分かりました(図3)。
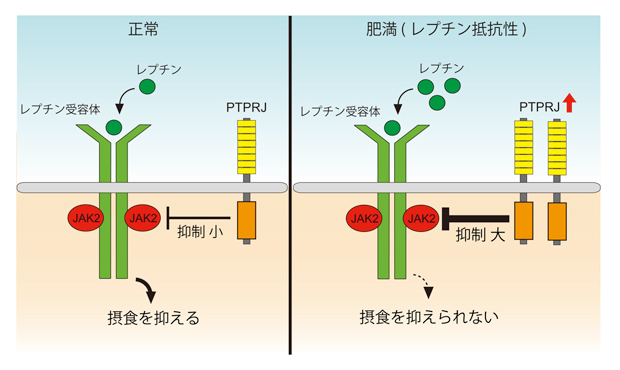
図3 レプチン抵抗性形成のメカニズム
PTPRJはレプチン受容体に会合したJAK2を脱リン酸化することで、レプチンの働きを抑制しています。肥満すると摂食中枢でPTPRJの発現が増えます。この結果、レプチン量が増加するにもかかわらず、レプチンが効きにくくなるレプチン抵抗性が生じていると考えられます。
【今後の展望】
世界中で肥満者の割合が急増しています。ヨーロッパやアメリカなどでは、1980年まで10人に1人未満であった肥満者(BMI 30 kg/m2以上)が、2013年には5人に1人まで増えており、今後も増え続けることが確実視されています。日本においても、2016年の肥満者(日本肥満学会の定義でBMI 25 kg/m2以上)の割合は男性で約30%、女性で約19%に上っており、年々増加傾向にあります。体重が数%減少するだけで、高血糖や脂質代謝異常、肝機能、高血圧が改善することがわかっており、世界保健機構(WHO)は肥満者を減少させることを最優先課題の一つとして提言しています。
今回、PTPRJがレプチン受容体の働きを抑制していること、さらにレプチン抵抗性の発症に関わることが明らかになったことから、PTPRJを阻害する薬剤は肥満の治療薬となりうることが判りました。すなわち、PTPRJの活性を阻害することによってレプチン受容体に対する抑制が解除され、レプチン抵抗性が改善すると考えられます。一方、本研究グループは、PTPRJがインスリンの働きを抑制していることをすでに明らかにしています。今後、糖尿病とともに肥満を改善する治療薬として、PTPRJを標的とする薬剤が開発されることが期待されます。
【発表雑誌】
Scientific Reports 2017年9月14日 オンライン掲載
論文タイトル: PTPRJ Inhibits Leptin Signaling, and Induction of PTPRJ in the Hypothalamus Is a Cause of the Development of Leptin Resistance
著者:Takafumi Shintani, Satoru Higashi, Ryoko Suzuki, Yasushi Takeuchi, Reina Ikaga, Tomomi Yamazaki, Kenta Kobayashi, and Masaharu Noda
DOI:10.1038/s41598-017-12070-7
【研究グループ】
本研究は、基礎生物学研究所・統合神経生物学研究部門の野田昌晴教授と新谷隆史准教授が中心となり、国立健康・栄養研究所並びに生理学研究所との共同研究により実施されました。
【研究サポート】
本研究は、文部科学省科学研究費助成事業及び民間助成団体の支援を受けて行われました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 統合神経生物学研究部門
教授:野田 昌晴 (ノダ マサハル)
TEL: 0564-59-5846
E-mail: madon@nibb.ac.jp
【報道担当】
基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press@nibb.ac.jp