
基礎生物学研究所




2017.01.24
基礎生物学研究所・多様性生物学研究室の鎌田芳彰助教は、細胞がアミノ酸を感知する仕組みを、出芽酵母を用いて探究しました。その結果、アミノ酸センサーとして知られるトア複合体1がtRNAを介してアミノ酸をモニターしていることを発見し、細胞内アミノ酸モニタリングの新規モデルを提唱しました。この研究成果は、日本分子生物学会が発行する国際誌Genes to Cells誌(2017年2月号)に発表されます(電子速報版は1月13日付で公開されました)。
【研究の背景】
20種類のアミノ酸は、細胞の基本的構成成分・タンパク質の材料です。従って、アミノ酸は、20種類すべてが重要な栄養源であり、細胞が正常にタンパク質合成を行うためには、「アミノ酸の在庫管理」、全種類のアミノ酸のモニタリングが必要です。アミノ酸モニタリングにはトア複合体1(TORC1)が必須の役割を担っています。TORC1は真核細胞に広く保存されたプロテインキナーゼで、TORC1キナーゼ活性はアミノ酸栄養状態により制御されるため、TORC1はアミノ酸センサーとして考えられています。しかしながら、TORC1が20種類のアミノ酸をモニターするメカニズムについては不明でした。
そこで本研究では、真核細胞のモデル系である出芽酵母を用いて、TORC1の活性制御に関わる遺伝子を調べました。
【研究の成果】
その結果、アミノアシル-tRNA合成酵素(ARS)やアミノアシル-tRNAに結合するタンパク質翻訳因子(EF1A)をコードする遺伝子群の変異体では、アミノ酸栄養があるにもかかわらずTORC1は不活性化されました(図1)。ARSはアミノ酸をtRNAと結合させてアミノアシル-tRNAを合成する酵素であり、アミノアシル-tRNAはEF1Aによってリボソームへ運ばれ、タンパク質合成の直接の材料となります。アミノ酸栄養豊富な条件下ではほとんどのtRNAはARSによりアミノアシル-tRNAに変換されタンパク質合成に使われますが、一方、アミノ酸飢餓条件では、tRNAが蓄積します。
さらに、TORC1のin vitroキナーゼ活性を測定すると、tRNAによりTORC1は直接阻害を受けることが解りました(図2)。
これらの実験結果により、TORC1はアミノ酸自身を認識するのではなく、アミノアシル-tRNAをアミノ酸情報として、またtRNAをアミノ酸飢餓情報として認識していることが示唆されました。
本研究の結果を基に、細胞内アミノ酸モニタリングの新規メカニズムを提唱しました(図3)。アミノ酸栄養豊富な環境では、tRNAはアミノアシル化され、それらはEF1Aと結合し、タンパク合成に使われるので、アミノアシル-tRNAはTORC1を直接阻害することはありません。依ってTORC1キナーゼ活性は高く保持されます。一方、アミノ酸飢餓環境では、アミノアシル化されないtRNAが蓄積し、TORC1を直接阻害します。
【考察】
このモデルは2つのメリットがあります。1つはアミノ酸とtRNAは1対1対応するので、1種類のアミノ酸欠乏は、それに対応するtRNAをフリーにし、TORC1を阻害する機会を生む、つまり全種類のアミノ酸のモニタリングを行える点です。もう1点は、アミノ酸は細胞質のみならず細胞内のさまざまなオルガネラにプールとして存在しますが、タンパク質合成の直接の材料であるアミノアシル-tRNAをアミノ酸情報として捉えることにより、タンパク質合成に使用可能なアミノ酸の「在庫管理」をより的確に行うことができる点です。
本研究は出芽酵母を用いた実験結果ですが、モデルに登場する制御因子群は、酵母から高等動植物まですべての真核生物に保存されています。今後は、このモデルの詳細なメカニズムを明らかにするとともに、高等動植物細胞にもこのモデルが適用できるか調べる予定です。
アミノ酸センシング、タンパク質合成は細胞にとって基幹をなす現象で、さまざまな高次生命現象に影響を及ぼします。例えば、TORC1はオートファジーの誘導制御に重要な役割を果たしていますし、「腹八分目」で知られるカロリー制限による寿命の延長にもTORC1が深く関わっていることが知られています。本研究で提唱されるアミノ酸によるTORC1制御モデルが広く証明されれば、これらの研究の発展にも役立つことが期待されます。
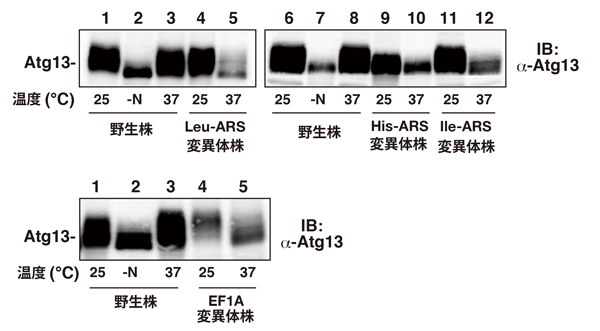
図1 ARS, EF1AはTORC1活性に必須である。
TORC1基質であるAtg13のウエスタンブロット。
TORC1キナーゼ活性は富栄養条件では活性化され、Atg13をリン酸化して高分子量側にバンドシフトを起こすが、栄養飢餓条件(-N)では不活性化され、Atg13は脱リン酸化された。野生株では、高温(37°C)で培養してもTORC1活性は影響を受けない。一方、種々のARS高温感受性変異体(上段)、EF1A高温感受性変異体株(下段)では、細胞を高温条件に移してその機能を失わせると、栄養源があるにもかかわらずTORC1は不活性化されて、Atg13は脱リン酸化された。
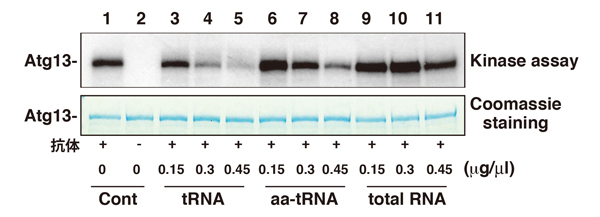
図2 TORC1キナーゼ活性はtRNAにより阻害を受ける。
酵母細胞から免疫沈降したTORC1(Lane2は抗体抜きのコントロール)に[g-32P]ATP, Atg13タンパク、表示した濃度(0〜0.45 mg/ml)のRNAを加え、in vitro TORC1キナーゼ活性を測定した。tRNA (Lane 3-5), アミノアシル-tRNA (aa-tRNA, Lane 6-8)は濃度依存的にTORC1活性を阻害した。一方、リボソームRNAが大半のtotal RNA (Lane9-11)では阻害効果が見られなかった。細胞内では、アミノアシル-tRNAはEF1Aに結合しタンパク合成に使われるため、TORC1を阻害するチャンスは低いと考えられる。
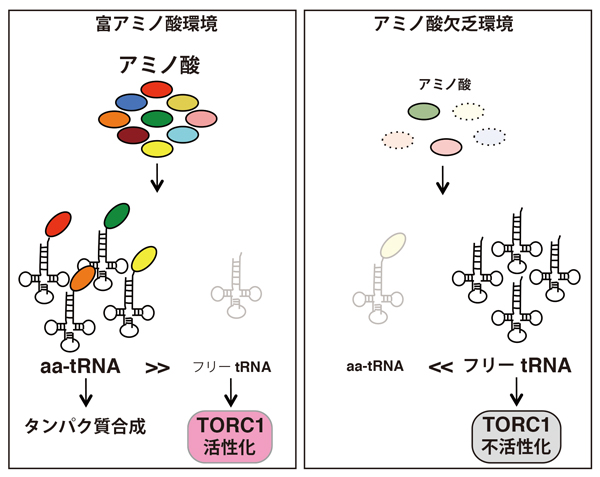
図3 本研究で提唱した細胞内アミノ酸モニタリングモデル
tRNAを利用したTORC1によるアミノ酸モニタリングモデル。
(左)アミノ酸存在下では、tRNAはアミノ酸がチャージされアミノアシル-tRNAになり、eEF1Aに結合してタンパク合成に使われる(1秒間に約半分のアミノアシル-tRNA分子がタンパク質合成に使用される)。従って、フリーなtRNAがTORC1を阻害するチャンスは少ない。
(右)アミノ酸飢餓下では、フリーなtRNAが増加し、TORC1は阻害を受ける(図2に示す実験からは、およそ細胞内の10%程度のtRNAによりTORC1を阻害できる)。
【論文情報】
Genes to Cells Vol. 22 Issue 2 (2017)
論文タイトル:Novel tRNA function in amino acid sensing of yeast Tor complex1
著者:Yoshiaki Kamada
DOI: 10.1111/gtc.12462
http://onlinelibrary.wiley.com/doi/10.1111/gtc.12462/abstract
【研究サポート】
本研究は、文部科学省科学研究費補助金のサポートを受けて行われました。
【本件に関するお問い合わせ先】
基礎生物学研究所 多様性生物学研究室
助教:鎌田 芳彰(カマダ ヨシアキ)
Tel: 0564-55-7536
E-mail: yoshikam@nibb.ac.jp