
基礎生物学研究所




2012.03.22
基礎生物学研究所・細胞間シグナル研究部門の篠原秀文助教、松林嘉克教授らの研究グループは、植物の形態形成に関わるペプチドホルモン受容体のひとつであるBAM1のリガンド認識機構を解明しました。ホルモン受容体の活性化のメカニズムの解明につながる成果です。この成果は、2012年2月9日にPlant Journal誌にて発表されました。
[研究の背景]
シロイヌナズナには600種類以上もの細胞膜貫通型受容体キナーゼが存在しており、分泌性のシグナル分子(リガンド)の認識に関与していると考えられています。なかでも、細胞外領域にロイシンリッチリピート構造(Leucine-Rich Repeat,LRR)を有するLRR型受容体キナーゼは200種類以上も知られており、これらの中には植物ホルモンのひとつであるブラシノステロイドの受容体や、いくつかのペプチドホルモンの受容体として機能している分子群も含まれます。しかし、リガンドが明らかになっているのはごく一部で、大半の受容体のリガンドや機能および活性化の機構は未知のまま残されています。
LRR型受容体のリガンド認識機構に関して、これまでにブラシノステロイド受容体BRI1や、ファイトスルフォカイン受容体PSKR1について生化学的な解析が行われ、いずれも細胞外領域LRR中に挿入された「アイランドドメイン」と呼ばれる、数十アミノ酸からなるLRRから孤立した領域がリガンド結合部位であることが知られています。アイランドドメインのアミノ酸配列や長さは、個々の受容体に固有なものであることから、リガンド認識の特異性を生み出す部位だと考えられています。
しかしながら、アイランドドメインをもつLRR型受容体は少数派で、大部分はLRRのみを細胞外領域にもっています。近年ペプチドホルモンを認識、結合するLRR型受容体の報告例は増えつつあり、幹細胞の維持や形態形成など、植物の正常な生育に重要な情報伝達経路に関与することで注目を集めていますが、それらのLRR型受容体にはアイランドドメインが存在しないにもかかわらず、厳密にペプチドホルモンを認識し分けることができます。高度に保存された構造であるLRRのなかで、どの部位がリガンド認識を司っているのでしょうか?植物受容体キナーゼにおけるリガンド認識機構のさらなる解明に向けて、アイランドドメインをもたないLRR型受容体のリガンド認識部位の解析を行いました。
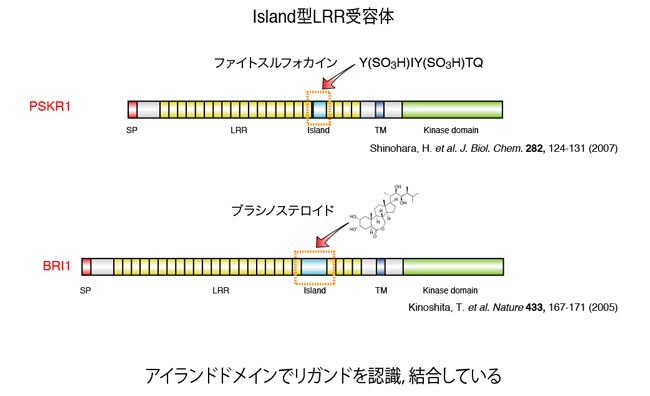
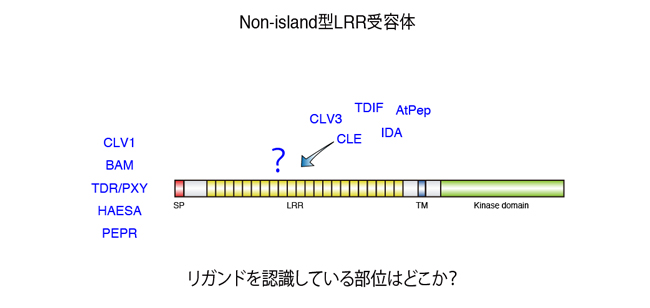
図1.LRR型受容体の構造とリガンド結合部位
[研究の成果]
アイランドドメインを持たないLRR型受容体のモデルとしてBAM1を用いました。BAM1は植物茎頂分裂組織の維持に必須であるLRR型受容体CLV1のホモログであり、bam多重変異体は植物の矮小化や葉の形態形成の異常、花粉形成の異常による稔性の低下などの多面的な表現型を示すなど、植物の生育に重要な役割を果たしているLRR型受容体です。
我々はペプチドホルモンのひとつであるCLE9ペプチドとそのホモログ群がBAM1に直接、特異的に結合することを見出し、BAM1のリガンドがCLE9ファミリーペプチド群であることを突き止めました。さらに光反応基および放射性標識を導入したCLE9ペプチド誘導体を合成し、BAM1に対してフォトアフィニティーラベルを行ってリガンド−受容体複合体を形成させた後、2種類の試薬で断片化しました。SDS-PAGEおよびオートラジオグラフィーの結果と断片の理論分子量との比較から、BAM1におけるリガンド結合部位がLRRの6−8番目という、比較的N末端に近い位置に存在することを見出しました。このリガンド結合部位付近に変異を導入すると、CLE9はBAM1に結合できなくなることも確かめられたことから、LRRの6−8番目の構造がリガンド認識に重要であることが明らかになりました。BAM1の詳細な配列解析および立体構造のコンピュータ解析から、結合領域として同定された部位は高度に保存されているLRRのコンセンサス配列から若干逸脱しており、その乱れはすべてらせん構造の内側を向いていることがわかりました。リガンドはおそらくらせん構造の内側部分で認識されており、このわずかな配列の乱れが受容体のリガンド結合特異性を決定づけているものと考えられます。これはアイランドドメインのように比較的大きな挿入配列にリガンドが結合する受容体グループとは大きく異なる特徴です。また,BAM1におけるLRRの6−8番目は膜貫通領域から比較的離れた部位ですが、これはブラシノステロイド受容体BRI1のリガンド結合部位が膜貫通領域に近いLRR22と隣接したアイランドドメインであることと非常に対照的です。これらの結果は、LRR型受容体におけるリガンド認識機構が極めて多様性に富むことを示すものです。
今回、新たにアイランドドメインを持たないタイプのLRR型受容体のリガンド結合部位が明らかにされたことにより、このタイプのLRR型受容体の受容体活性化のメカニズムの解明が進むことが期待されます。
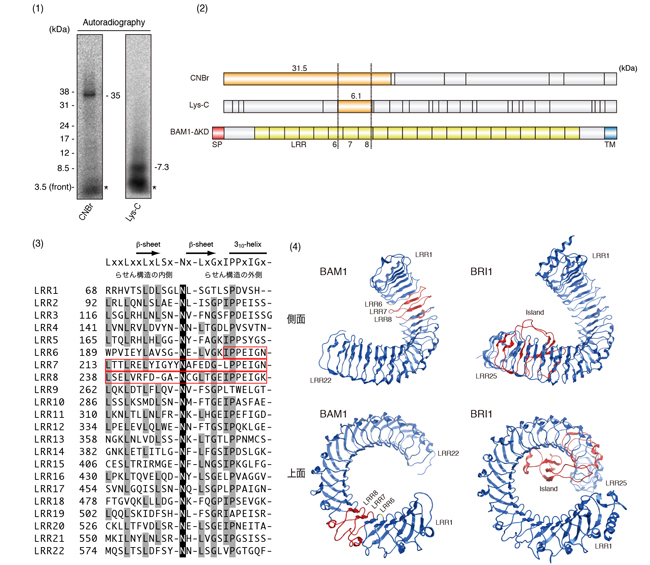
図2.BAM1のリガンド結合部位の同定
(1)ラベル導入したBAM1を断片化し、オートラジオグラフィーで検出した。(2)得られた断片の大きさと、理論上の断片の大きさを比較することで、リガンド結合部位がLRRの6–8番目に存在することが示された。(3)BAM1細胞外領域におけるLRRのアミノ酸配列。リガンド結合部位は赤線で囲われた部分。リガンド結合部位ではLRRに高度に保存されているアミノ酸の置換や欠失などがみられ、LRR構造に若干の乱れが生じていると推測される。(4)BAM1立体構造のコンピュータ予測結果(左側)。ブラシノステロイド受容体BRI1の立体構造(左側)と比較して、BAM1のリガンド結合部位は膜貫通部位から比較的遠い位置に存在することが示された。双方のリガンド結合部位は赤色で示してある。
[発表雑誌]
「Plant Journal」
2012年2月9日に電子版にて発表されました。
論文タイトル:“Biochemical mapping of a ligand-binding domain within Arabidopsis BAM1 reveals diversified ligand recognition mechanisms of plant LRR-RKs.”
「シロイヌナズナBAM1のリガンド結合ドメインの解析により明らかにされた植物LRR型受容体キナーゼの多様なリガンド認識機構」
著者:Shinohara Hidefumi, Yuji Moriyama, Kentaro Ohyama, Yoshikatsu Matsubayashi