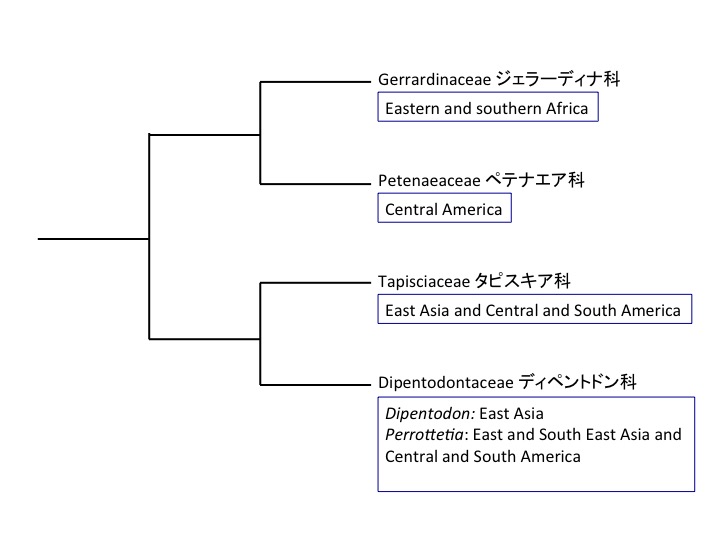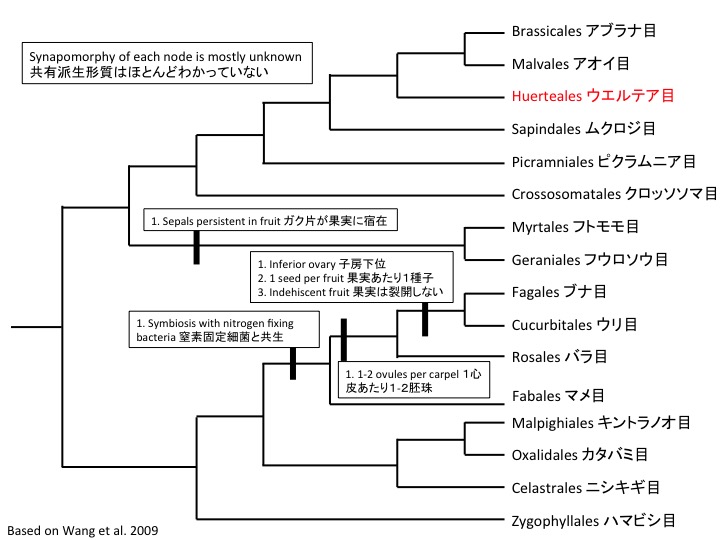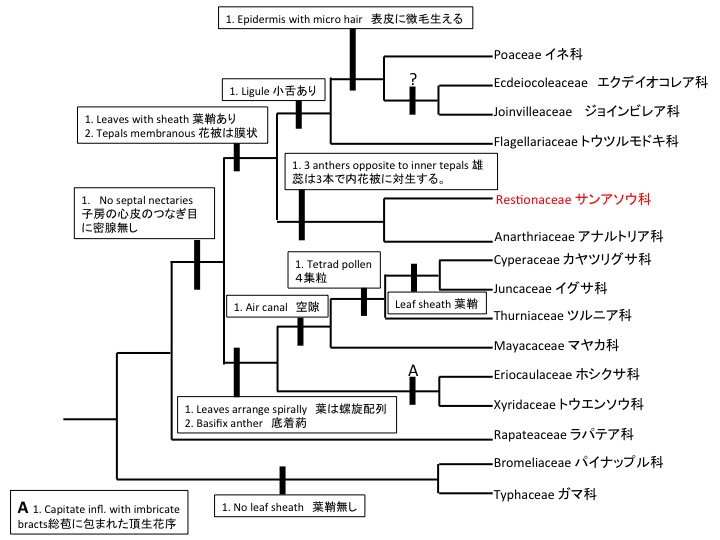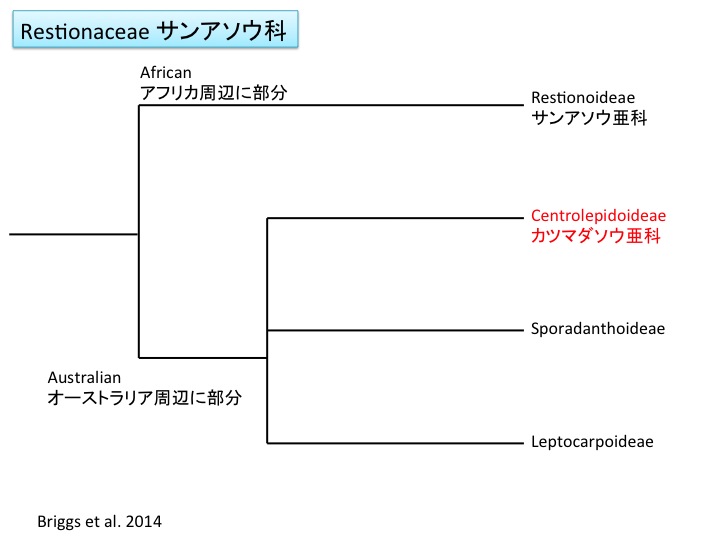
Petrosaviales サクライソウ目

Petrosaviaceae サクライソウ科 Japonolirion オゼソウ属 Petrosavia サクライソウ属
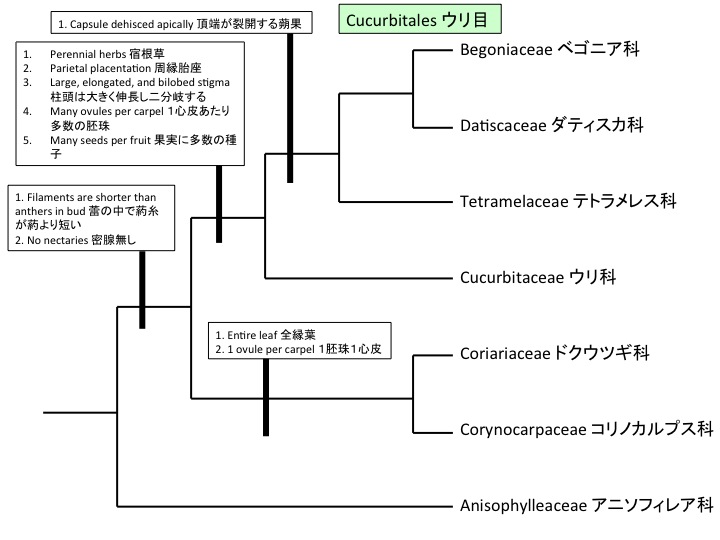
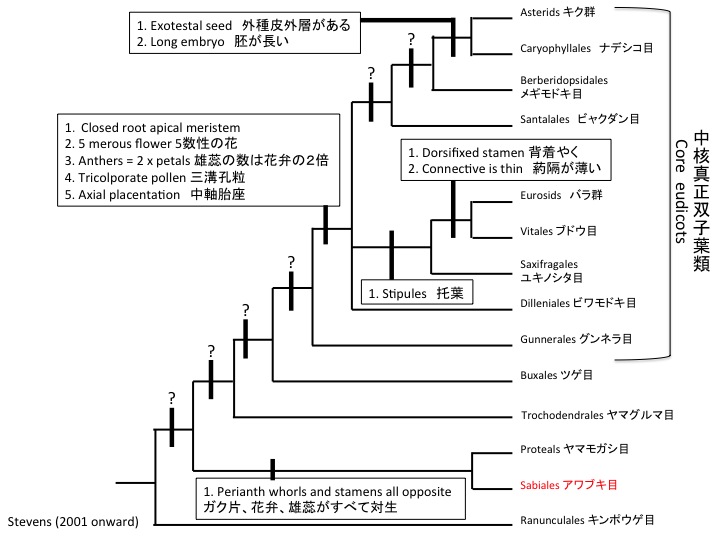
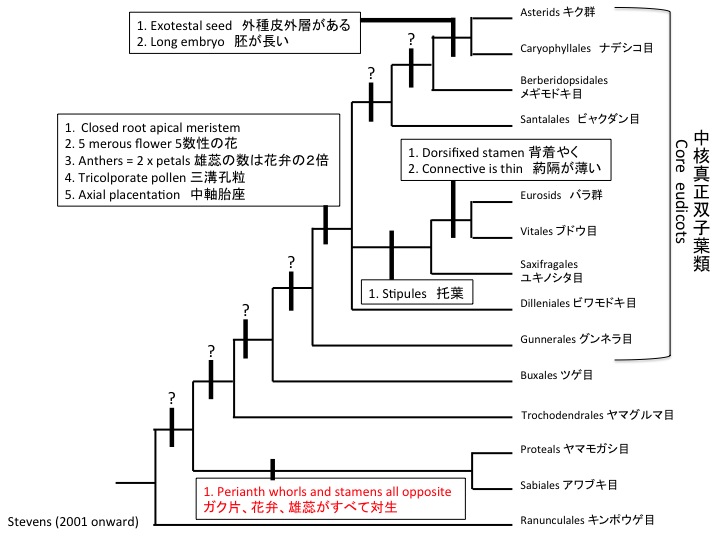
サクライソウ目にはサクライソウ科1科があり、日本固有のオゼソウ属と東アジアと東南アジアに分布するサクライソウ属の2属からなる。オゼソウは光合成能力のある葉を持ち独立栄養であるが、サクライソウ属は腐生である。サクライソウの仲間のPterosavia stellarisの葉緑体ゲノムが解読されており、光合成をしないためいくつかの遺伝子が欠損するとともにゲノムサイズが小さくなっている(Logacheva et al. 2014)。しかし、ATP合成酵素やrbcL遺伝子は残っており、光合成以外に必要なのかもしれない(Krause 2008)。rbcLについては脂質合成(Schwender et al. 2004)やRNA結合タンパク質(Yosef et al. 2004)として機能することが知られている。核ゲノムの解読によって、腐生化によって遺伝子レベルで何が変わっているのかが明らかになるだろう。
Pterosabiales contains a monotypic family Pterosaviaceae, which includes Japanolirion endemic to Japan and Pterosavia distributed in East and South Eastern Asia. Japanolirion osense forms green leaves and is autotrophic, while Pterosavia ssp. are saprophytic. Chloroplast genome of Pterosavia stellaris is reduced (Logacheva et al. 2014) but ATP synthase, rbcL and some other genes are still retained. The reason why these genes usually function in photosynthesis are retained is unknown but may function in other ways (Krause 2008). rbcL is revealed to function in lipid synthesis (Schwender et al. 2004) and as RNA binding protein (Yosef et al. 2004). No saprophyte genomes were published and such study will give insight on the evolution at the gene level.
Krause, K. (2008). From chloroplasts to “cryptic” plastids: evolution of plastid genomes in parasitic plants. Curr. Genet. 54: 111-121.
Logacheva, M.D., Schelkunov, M.I., Nuraliev, M.S., Samigullin, T.H., and Penin, A.A. (2014). The plastid genome of mycoheterotrophic monocot Petrosavia stellaris exhibits both gene losses and multiple rearrangements. Genome Biol. Evol. 6: 238-246.
Schwender J, GoVman F, Ohlrogge JB, Schachar-Hill Y (2004) Rubi- sco without the Calvin cycle improves the carbon eYciency of developing green seeds. Nature 432:779–782.
Yosef I, Irihimovitch V, Knopf JA, Cohen I, Orr-Dahan I, Nahum E, Keasar C, Shapira M (2004) RNA binding activity of the Ribu- lose-1, 5-bisphosphate carboxylase/oxygenase large subunit from Chlamydomonas reinhardtii. J Biol Chem 279:10148–10156.

Petrosaviaceae サクライソウ科 Japonolirion オゼソウ属 Petrosavia サクライソウ属

Petrosaviaceae サクライソウ科 Japonolirion オゼソウ属 Petrosavia サクライソウ属
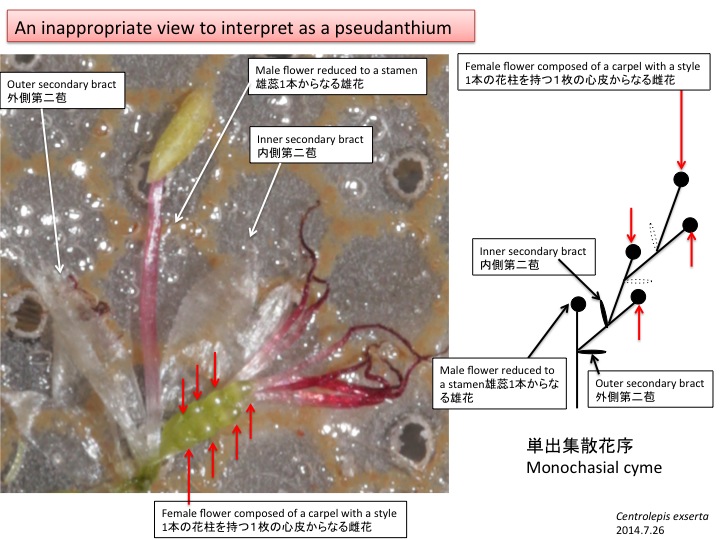
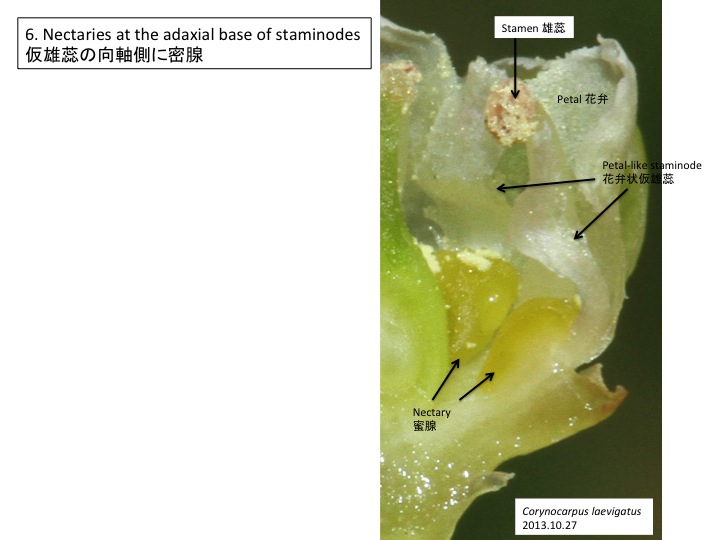
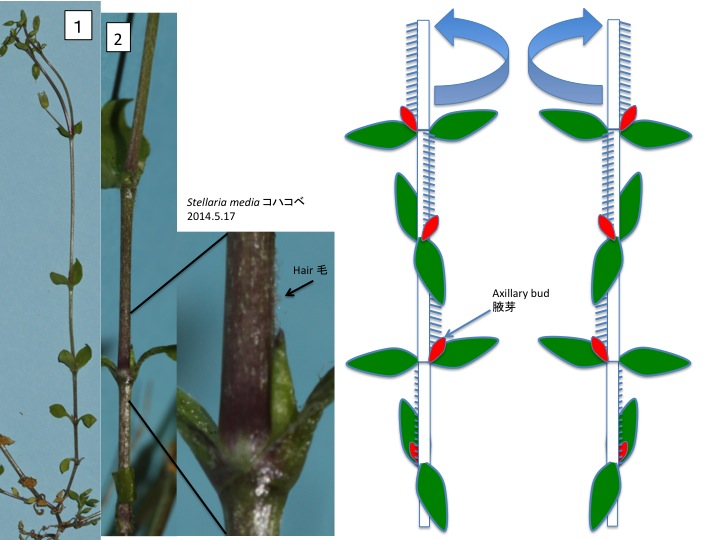
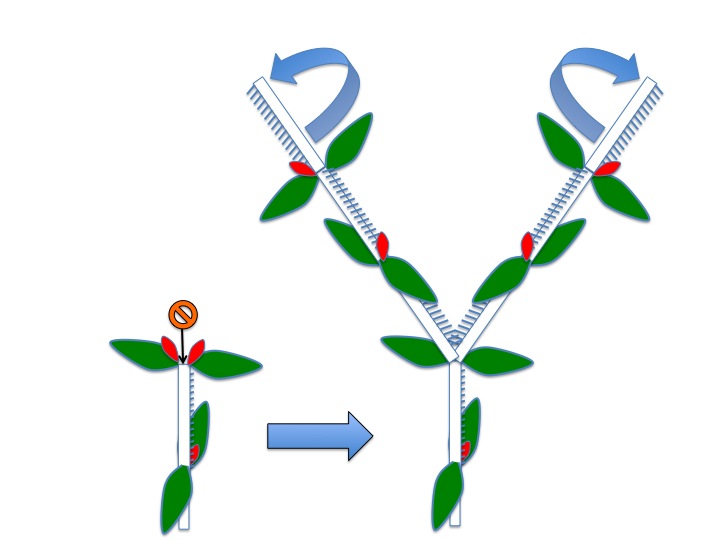
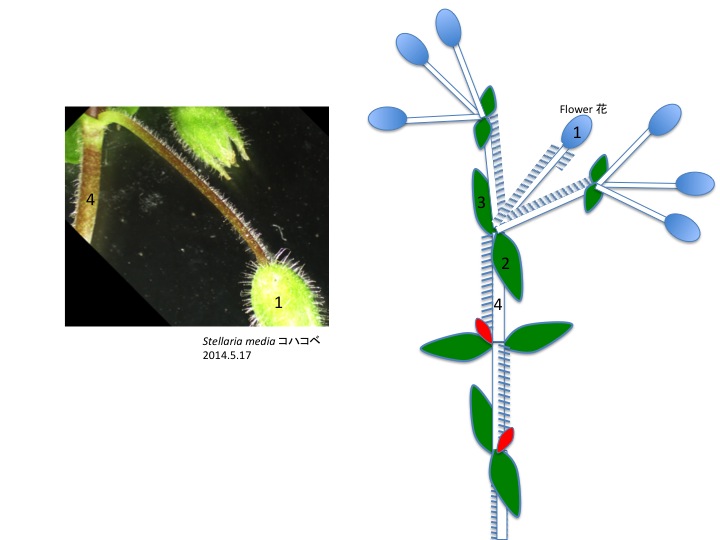
花茎上で各花に伸びる組織が花序茎表面に畝状に見える。各花に伸びる維管束が、花の形成される位置よりも基部側で花序維管束から分離しているのだろうか。花は苞と小花梗の向軸側に形成される前葉の2つの花器官によって抱かれている。他の分類群でも前葉は見られるが、どうしてあったりなかったりするのだろうか。
Ridges on an inflorescence stem are connected to flowers. It is unknown why this structure is formed in both structural and adaptive senses. A flower is subtended by a bract and a prophyll. The function of prophyll is unknown.
- Petrosaviaceae サクライソウ科 Japonolirion オゼソウ属

Petrosaviaceae サクライソウ科 Japonolirion オゼソウ属 Petrosavia サクライソウ属
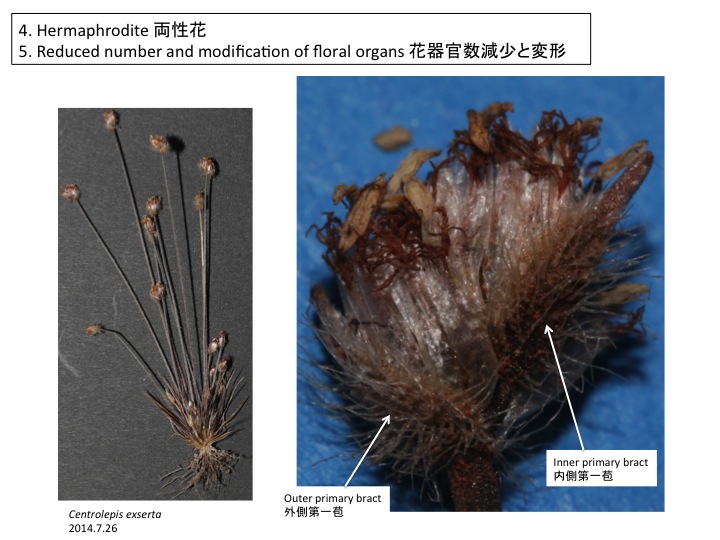
オゼソウ、サクライソウの仲間ともに、花序の基部側に5個くらいの花を付けない苞が形成される。
In both Japanolirion and Pterosavia, bract-like organs are formed on the inflorescence.