
基礎生物学研究所




多くの動物は、長期間にわたり多数の精子を生み出すことで確実に子孫を残します。一方、一つ一つの精子は遺伝情報を正しく次世代に伝えます。ヒト男性は、1日一億個、一生に兆を越える精子を作ります。しかし、次世代に伝わる突然変異はゲノム(3x109塩基対)あたりわずか数十に過ぎません。体細胞よりも遥かに少なく、驚異的な正確性と言えます。一見相反する、しかし生命にとって本質的な、高い生産性と正確性はいかにして実現されているのでしょうか?生殖細胞研究部門は、精子幹細胞に注目してこの謎に挑戦しています。
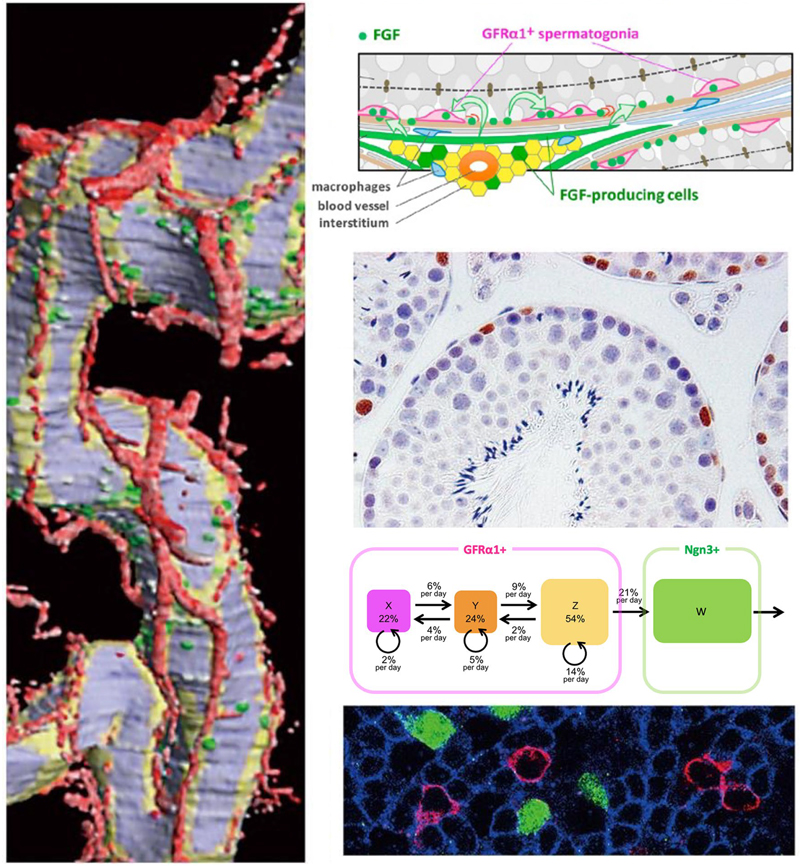
マウス精巣と精子形成のさまざまなイメージ。
(左)精細管の3D再構成像。緑色の未分化型精原細胞は、血管(赤色)の付近に偏っている。
(右上から下へ)精子幹細胞が動き回りながら自己複製因子(FGF)を奪い合う概念図。分化に向かった未分化型精原細胞の染色像(茶色)。精子幹細胞が異なるステートを転換するダイナミクス。精細管の免疫染色像。異なる色に染まる様々な分化段階の細胞が入り混じっている。図は文献3、6より許諾を得て転載。
「生産性と正確性」の鍵を握る存在が「精子幹細胞」です。自己複製と分化の絶妙なバランスをとることで、精子が枯渇することも、未分化な細胞がたまることもなく、一生にわたって精子を作り続けます。1950から70年代に、精子幹細胞はどの細胞で、どのように自己複製と分化のバランスをとるのか、いくつかの説が出されました。しかし、固定標本で細胞運命を語るのは原理的に限界があります。2000年代に入り私たちは、ライブイメージングやパルス標識などの技術を開発し、時間スケールを含む幹細胞の挙動を明らかにしてきました。さらに、得られた定量データを用いて数理モデル解析や統計解析を行い、幹細胞のふるまいを支配する、実にシンプルな原理を明らかにしてきました。
幹細胞は、特別な「ニッチ」で、厳密に「非対称分裂」を行い、娘細胞の一つが自己複製、一つが分化するという考えが一般的でした。しかし、ライブイメージングやパルス標識から見えてきたのは、全く異なる幹細胞の姿でした。精巣の中で幹細胞は、血管近くに高い頻度で見つかる一方、一箇所に留まることなくランダムに動き回っていました(文献4, 6)。分裂した後の運命もランダムでした。一例として100個の幹細胞を追跡すると、それぞれの子孫クローンには、一つ残らず分化したものもあれば幹細胞を多く含むものもあり、一定のパターンはありませんでした。しかし、100個のクローン全体では、幹細胞の数は時間が経っても100個に保たれていました。自己複製と分化は、細胞集団レベルで釣り合っていたのです。これは「集団非対称」と呼ばれます(文献4)。
幹細胞はまた、一旦分化に向かうと二度と自己複製しないと思われてきました。私たちは、未分化と分化の間には中間の状態がいくつかあり、細胞は段階的かつ可逆的に分化することを見つけました。組織が障害を受けたり幹細胞を移植した時には、これらの状態の間を転換する確率が変化して、すみやかに、かつしなやかに組織を再構成することもわかりました。これを利用して精子幹細胞の移植効率を格段にアップさせることにも成功しています(文献1, 2, 5)。
このように柔軟にふるまうにもかかわらず、組織中の幹細胞の数(密度)は一定で安定しています。それはなぜか?我々は、一つの答えを見出しました。幹細胞は、動き回りながら、組織中の自己複製因子(FGF)を消費することでお互いに競合します。その結果、自ずから、自己複製と分化のバランスが取れるという新しい考え方で、mitogen competitionモデルと呼んでいます(文献3)。
現在は、幹細胞が異なる状態を転換する分子メカニズムや、組織の中で秩序だった時空間パターン「周期と波」を作りながら分化が進行することで、効率よく安定的に精子を作るメカニズムの解析を進めています。
精子幹細胞に関するこれらの知見をもとに、「正確性」を維持するメカニズムの研究へと展開しています。鍵の一つは、幹細胞の中でも最も未分化で、最もゆっくり分裂するPlvap陽性の亜集団です(文献1)。突然変異の主な起源は、細胞分裂に伴うDNA複製エラーと考えられていることからも、この細胞に興味を持って解析しています。さらに、次世代に伝わる生殖細胞の系譜動態の解析や、変異が生じた幹細胞のクローンが非中立に拡大する現象の解析を通して、「正確性」の問題に挑んでいます。
マウスの精子形成幹細胞にフォーカスを絞り、組織形態学・遺伝子発現・ライブイメージング・遺伝学を用いて多角的に解析しています。マウス等の動物の精子形成の解析、遺伝子発現解析やライブイメージング技術を用いた共同研究を募集します。
生殖細胞は生命の本質に直結します。大学院生には、こういった問いに具体的な実験で挑戦することを通して生物学の醍醐味を味わい、自分自身の興味に従って考える力を身につけて欲しいと思っています。
吉田 松生 教授 E-mail: shosei@nibb.ac.jp
