
基礎生物学研究所




真核生物の細胞内には、小胞体やゴルジ体など様々なオルガネラがあり、それぞれが独自の機能を果たすことで生命現象が成り立っています。これらのオルガネラ間では小胞や細管を介した膜交通と呼ばれるメカニズムによって物質が運ばれています。膜交通の基本的なメカニズムは真核生物において広く保存されていますが、それぞれ生物が独自の膜交通の仕組みを有していることも明らかになりつつあります。我々は、シロイヌナズナとゼニゴケを用いて、植物における膜交通の普遍性と独自性を明らかにするべく研究を行なっています。
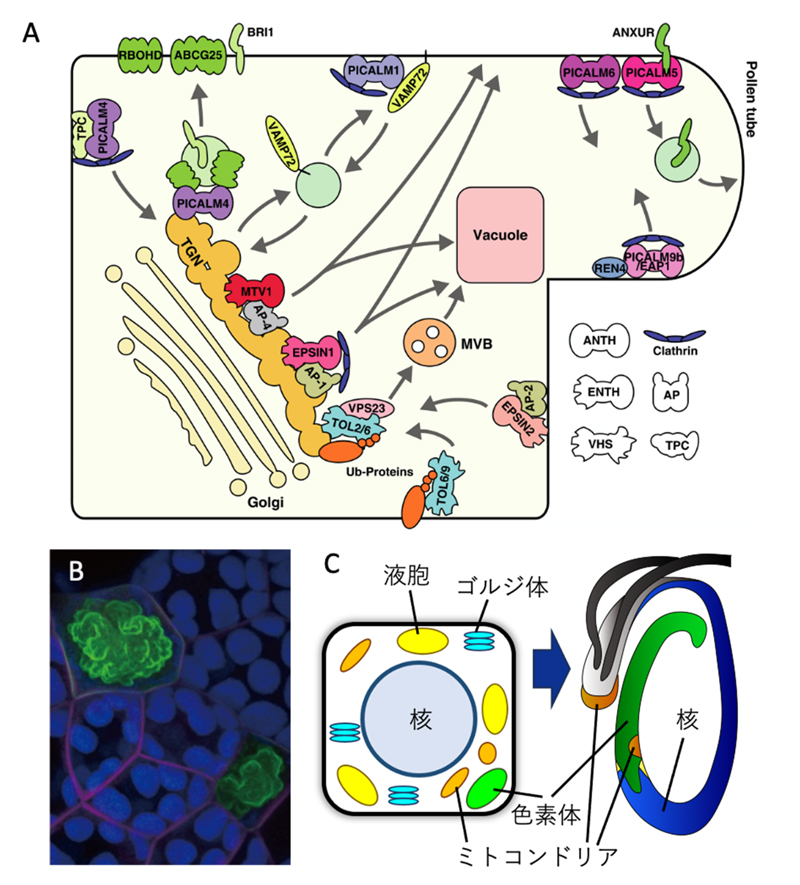
植物細胞における膜交通経路の多様化。
(A)シロイヌナズナの細胞膜やtrans-Golgi network(TGN)では様々なアダプタータンパク質複合体が積荷タンパク質を選別している(文献5,6に関連)。(B)ゼニゴケ葉状体細胞において、分泌経路ではたらく膜融合因子(SNARE)の一種であるMpSYP13B(マゼンタ)が細胞膜に局在するのに対し、ホモログであるMpSYP12B(緑)は油体膜に主に局在する。分泌経路で機能するSNARE分子の機能が進化の過程で多様化していることが分かる。(C) ゼニゴケは雄性配偶子として運動能をもつ精子を形成する。精子形成過程におけるオルガネラの再編成には、膜交通やオートファジーが重要な役割を担っている。(文献2,3より改変)
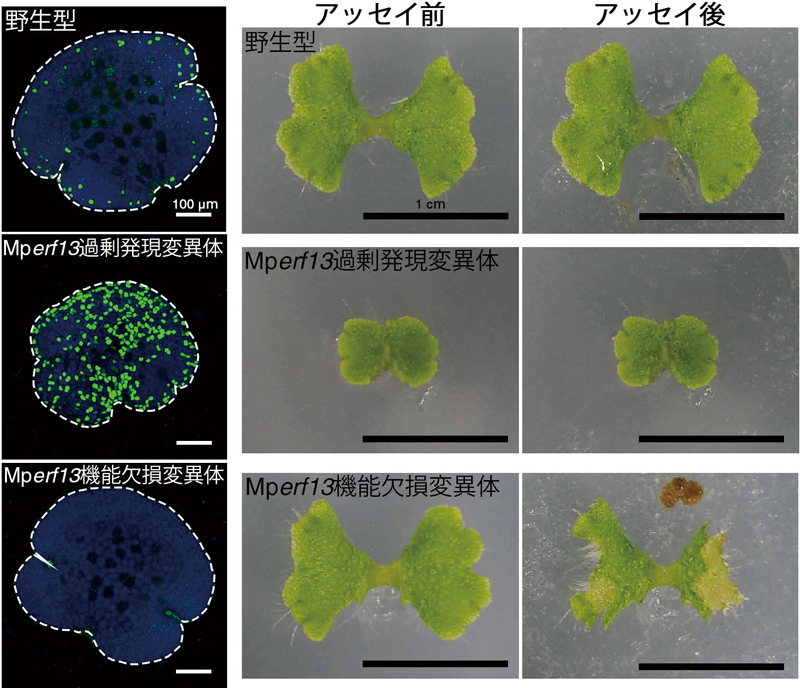
図1.油体の形成と機能。
油体形成マスター転写因子MpERF13の過剰発現変異体では油体が過剰に形成され、機能欠損変異体では油体が全く形成されない。オカダンゴムシを用いた被食アッセイでは、油体を持たない変異体が多く被食される(文献4より改変)。
進化の過程における膜交通の多様化は、植物の様々な生理機能の発現と密接に関連している。例えばクラスリン依存的なエンドサイトーシスにおいてアダプターとして機能するPICALMは、植物の進化の過程で劇的に多様化している。シロイヌナズナでは、PICALM1が栄養成長期に細胞膜からのタンパク質の回収を担うことで成長や発生に重要な役割を果たすのに対し(文献5)、PICALM5が花粉管で生殖過程に必須の細胞膜タンパク質のリサイクリングに関わっている(文献6)。ゼニゴケでは、キナーゼドメインを有するユニークなPICALMに注目し、AIを援用してこれが精子の運動に関わることを突き止めた。さらに、ゼニゴケの精子変態の過程で、オルガネラの再編成にオートファジーやエンドサイトーシスを介したオルガネラ分解が必須であることも見出した(文献2,3)。引き続き、植物の生殖過程に起こる様々なオルガネラ再編成の仕組みと意義を明らかにするべく解析を進めている。
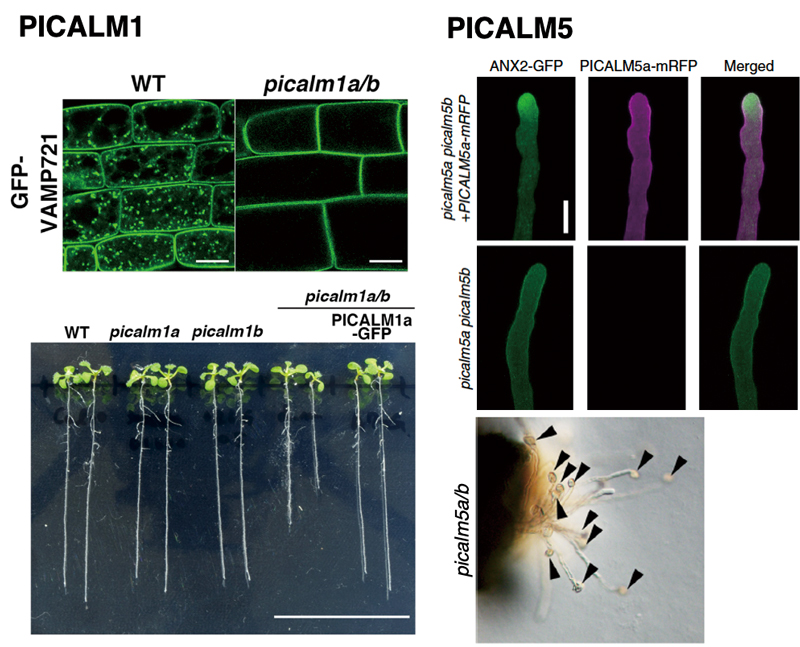
図2. PICALMはシロイヌナズナの多様な発生段階で機能する。
(左図)PICALM1が欠失すると、栄養器官における細胞膜からのタンパク質の回収がうまくいかず、植物の栄養生長の様々な段階に異常をもたらす(文献5より改変)。(右図)PICALM5の欠失は伸長中の花粉管における細胞膜からの特定のタンパク質の回収が異常になり、花粉管が伸長中に破裂してしまう(文献6より改変)。
上田 貴志 教授 E-mail: tueda@nibb.ac.jp
