
基礎生物学研究所




ほ乳類の受精卵は対称な形をしていますが、細胞分裂を繰り返し発生が進むと明確な軸をもった胚の形ができあがり、様々に分化した細胞が秩序だって配置されます。ほ乳類の胚発生は卵管・子宮内で進むのが大きな特徴ですが、この胚発生を支える環境としての卵管および子宮と胚との相互作用も重要です。個々の細胞の変化や振る舞いをじっくり観察しながら、組織間、細胞間のコミュニケーションを通して作られる細胞の集団としての胚の形作りの理解を目指しています。マウス初期胚を主な研究対象とし、個々の細胞、遺伝子発現、物理的性質、タンパク質の挙動の解析を通して、ほ乳類における胚発生を考察します。軸形成、細胞分化、形態形成の基盤となる機構を明らかにすることを目標に据え、マウスの遺伝子操作、発生工学的技術、分子生物学的手法、顕微鏡技術、更に数理モデリングなどを応用し、発生生物学の基礎的な問題を解決したいと考えています。母親の胎内で発生を進め、ゆるやかに情報の具現化を進めるほ乳類初期胚を考えることで、生き物の持つ高い能力の理解を目指します。
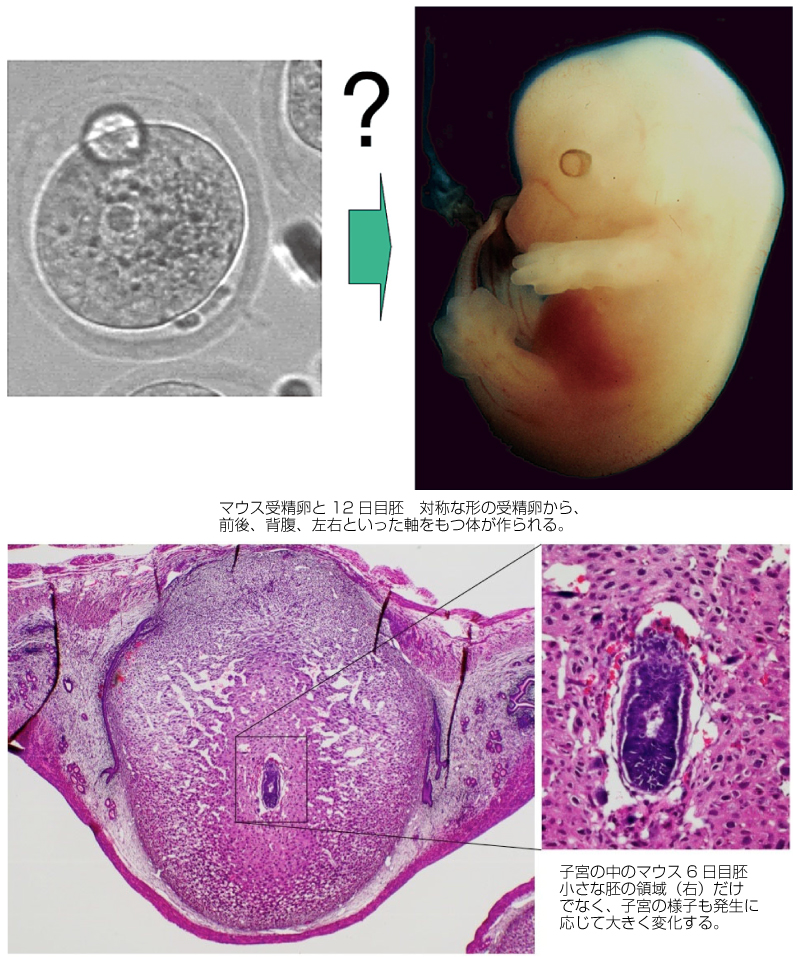
ほ乳類胚の発生には、子宮との相互作用が必須である。その始まりは、胚が子宮の内側の細胞層に接着することによっておきる「着床」である。着床の過程では、胚と子宮双方の形態やそれぞれの細胞の状態がダイナミックに変化することが明らかになってきた。着床時にはその後の胚発生に必要な栄養を母胎から効率よく得られるように、胚と子宮が相互作用しながら将来の胎盤の位置も決められる。また胚と子宮の相互作用は、胚の前後・左右方向(胚軸)の決定にも関わっていることがわかりつつある。これらの相互作用はシグナル分子などを介した機構と物理的な「力」を介した機構によって制御されると予想される。子宮と相互作用しながら、胚自身も自律的に胚軸の形成を進める。胚軸を決める際のそれぞれの細胞がどのように環境に応答し、細胞の運命や挙動が制御されるか、胚全体での軸が決められるかを解析している。このような胚と子宮の相互作用の実体を解明し、正常な胚の形づくりを実現する仕組みを明らかにしたい。
卵巣から放出された卵は卵管の中で受精し初期の胚発生が進む。卵管の内腔面の上皮細胞は管の長軸に沿った明確な細胞極性を有しており、卵管の上流部では多繊毛細胞が一方向的に繊毛を動かし胚を子宮側へ輸送する。卵管の極性に沿うようにそれぞれの卵管上皮細胞が極性を形成し、上皮組織の損傷や細胞の入れ換えが起きても一生に渡り細胞極性が維持される。明確な機能的極性を持つ器官の極性を維持する際に、それぞれの細胞が極性を獲得し、維持する基盤となる機構の解明を目指す。
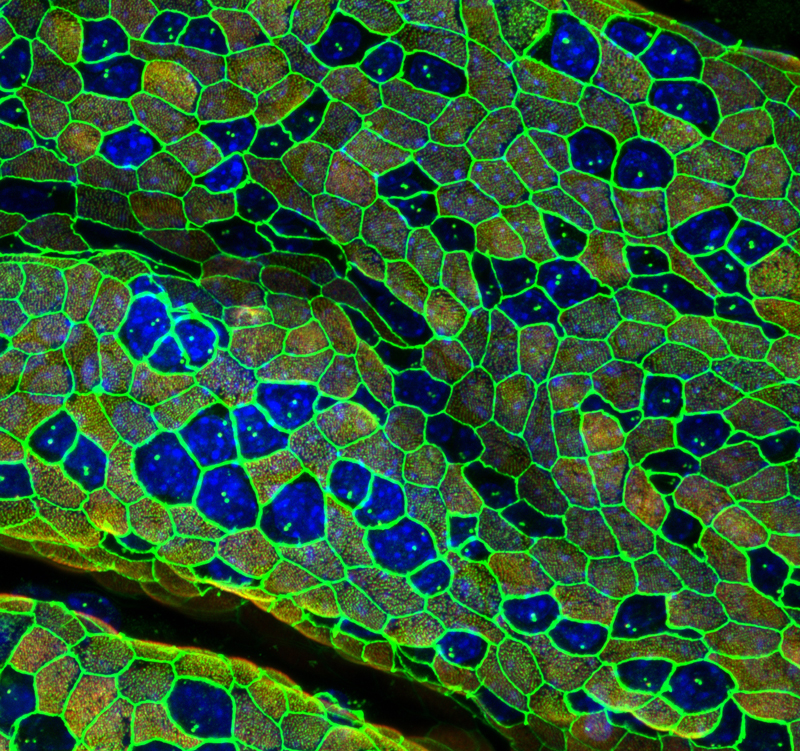
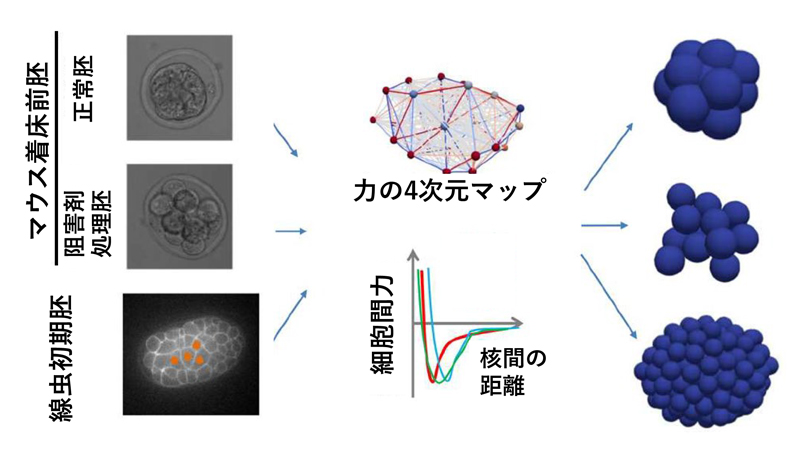
発生において、胚や各組織は多様な形態を示す。遺伝子産物は細胞の機械的(力学的)な性質を制御することで、胚や組織の形態を作り出していく。胚発生においては細胞の機械的な性質は時空間的に変化していくが、その全容はほとんどわかっていない。胚発生時の細胞や組織の動きの顕微鏡画像を用いた定量的な画像解析、および、それに基づいた力の統計数理的な推定等によって細胞の機械的な性質の変化を明らかにしたいと考えている。また、これらの解析結果や力の工学的な計測結果をもとに数理モデリングを行い、胚や組織の形態が実現される仕組みを研究している。マウスの初期胚や卵管・子宮の形態に着目して研究を進めており、これらの多様な形態を実現する機械的な機構や、その際の遺伝子産物の役割を理解することを目指す。
本研究部門では、マウス初期胚の解析を行っています。マウス初期胚に限らず、発生生物学研究一般の共同利用研究を募集しています。基本的な発生学の手法に加え、ライブイメージングや発生工学技術などを利用する共同研究を行うことが可能です。
本研究部門では、元気の良い大学院生を歓迎します。マウス初期発生の基本的なメカニズムを研究する方を募集します。体験入学によって研究室の研究内容や、雰囲気などを体験されることを推奨します。
<研究キーワード>発生、ほ乳類、細胞分化、体軸、形態形成、細胞極性、着床、ライブイメージング、画像解析、数理モデル、シミュレーション、ES細胞、発生工学、トランスジェニックマウス
藤森 俊彦 教授
E-mail: fujimori@nibb.ac.jp


