
基礎生物学研究所




個体発生の初期には、体を構成する全ての細胞種を生み出す能力(多能性)を持つ細胞群が出現します。地球上に存在する生物種の中には、このような多能性幹細胞を成熟個体でも維持するものがある一方で、哺乳類の多能性幹細胞は発生過程で失われ、これが再出現することはありません。幹細胞生物学研究室では、初期胚から樹立された多能性幹細胞(ES細胞)が、どのようにその性質とゲノム恒常性を維持しているか、その分子基盤を理解することを目指しています。また、実験的に体細胞へ分化多能性を誘導し、その細胞応答を理解することで、哺乳類においてどのような条件が揃えば多能性幹細胞の再獲得が実現されるのか、その機序解明を目指しています。
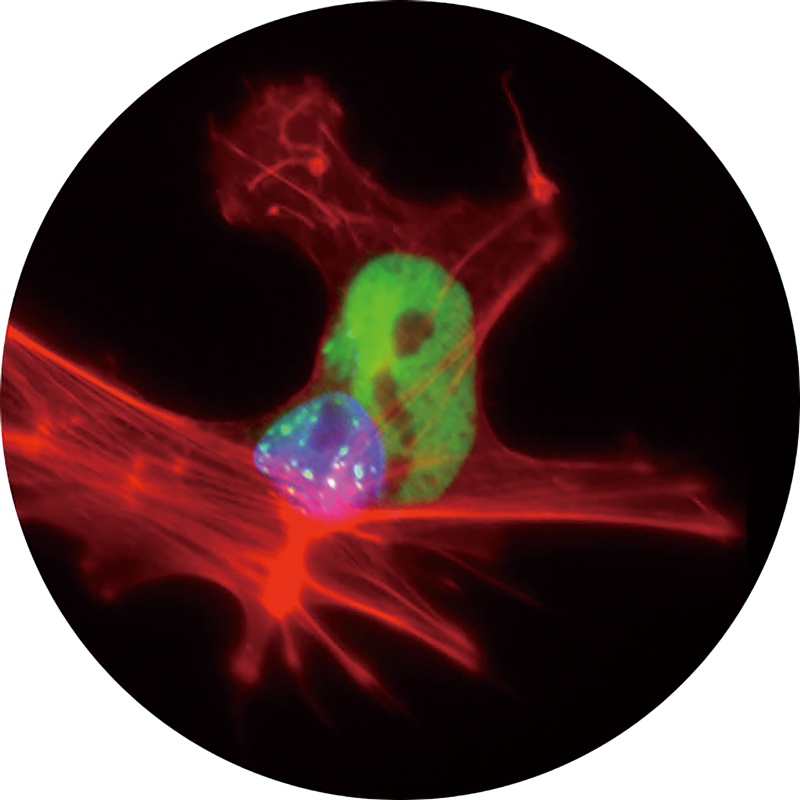
マウスES細胞とヒトB細胞の融合細胞(赤; F-Actin, 青+緑斑点; ヒトB細胞核, 緑; ES細胞核)。ES細胞と融合したB細胞には1日以内に多能性制御因子の発現上昇が起こる。我々の研究室では、融合細胞を使って多能性獲得過程を解析している。
多能性幹細胞は、DNA複製期と分裂期を休みなく繰り返し自己複製する特徴がある。このような盛んな細胞増殖を可能にするためにはどのような制御が働いているのか、また、多能性の維持に直接的にどのように関わっているのか、その全貌は明らかではない。私たちの研究室では、マウスES細胞と細胞融合を用いた多能性誘導系を用いて、多能性幹細胞特異的な自己複製機構とその生物学的意義を明らかにすることを目指している。
自己複製にはDNA複製が必須であるが、DNA複製の進行は様々な要因で阻害されるため、この過程でゲノム情報が損なわれやすい。近年の解析から、ES細胞のDNA複製装置が他の細胞種と比較して低速で進行することが明らかになっている(図1)が、その分子的背景及び生物学的意義は不明である。私たちの研究室では、ES細胞における低速なDNA複製速度が、ES細胞の多能性とゲノム恒常性維持に重要な役割を持つことを示しつつある。

図1.ES細胞と線維芽細胞のDNA複製フォーク速度
細胞に核酸(ヌクレオチド)のアナログを一定時間投与することで合成中のDNAに取り込ませ、取り込まれたアナログを可視化することでDNA複製フォークの進行速度を測定することができる。ES細胞では線維芽細胞と比較してDNA複製フォーク速度が遅いことが知られている。
ES細胞に線維芽細胞やリンパ細胞などの分化した細胞を融合させると、分化細胞の核に多能性幹細胞特異的因子の発現が誘導される。私たちは、融合細胞を顕微鏡下で追跡し、多能性幹細胞特異的因子の発現量を個々の細胞で評価することを可能にしたことで細胞周期の進行と多能性誘導が密接に関わっていることを見出している。多能性誘導過程を高い時間精度で理解することで、効率の良い多能性誘導とより安全な再生医療への応用に貢献できると考えている。
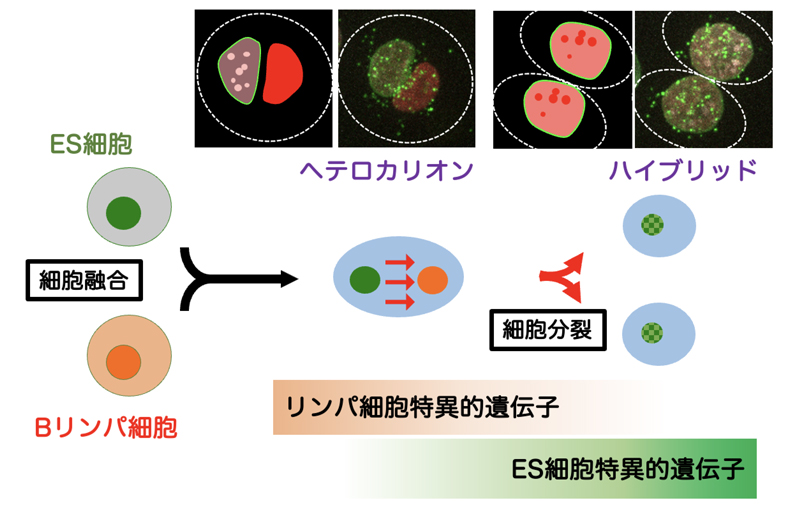
図2.細胞融合を使ったリンパ細胞への多能性導入
細胞融合直後はそれぞれの細胞由来の核が単一の細胞内で独立に存在するヘテロカリオンの状態となり、細胞分裂時に二つの核の情報が混ざり合い単一の核を有するハイブリッド細胞となる。融合細胞内ではリンパ細胞核におけるリンパ細胞特異的遺伝子の抑制、ES細胞特異的遺伝子の発現開始が1細胞周期内に起こる。図では白点線で示す単一細胞の中にBリンパ細胞由来の核(赤)とES細胞由来の核(緑)がヘテロカリオン・ハイブリッドの状態で共存する様子を示す。点状に局在する緑のシグナルはリンパ細胞由来のmRNA(Gapdh)分子を可視化したもの。
坪内 知美 准教授 E-mail: ttsubo@nibb.ac.jp
