
基礎生物学研究所




mRNAは、DNAの遺伝情報を基にタンパク質を合成(翻訳)するという、生命の根幹を担う分子です。正常な脳神経機能には、mRNAを鋳型とした翻訳の時空間的な制御が特に重要です。この制御は、mRNAとそれに結合する様々なタンパク質がRNA顆粒と呼ばれる集合体(コンデンセート)を形成することで実現します。私たちは、マウスをモデル生物として、RNA顆粒の形成過程や動態の調節メカニズム、さらに神経細胞(ニューロン)におけるRNA顆粒の機能が学習・記憶や精神活動などの脳の機能にどのような影響を与えるのかを、分子・細胞・個体レベルで明らかにすることを目指しています。
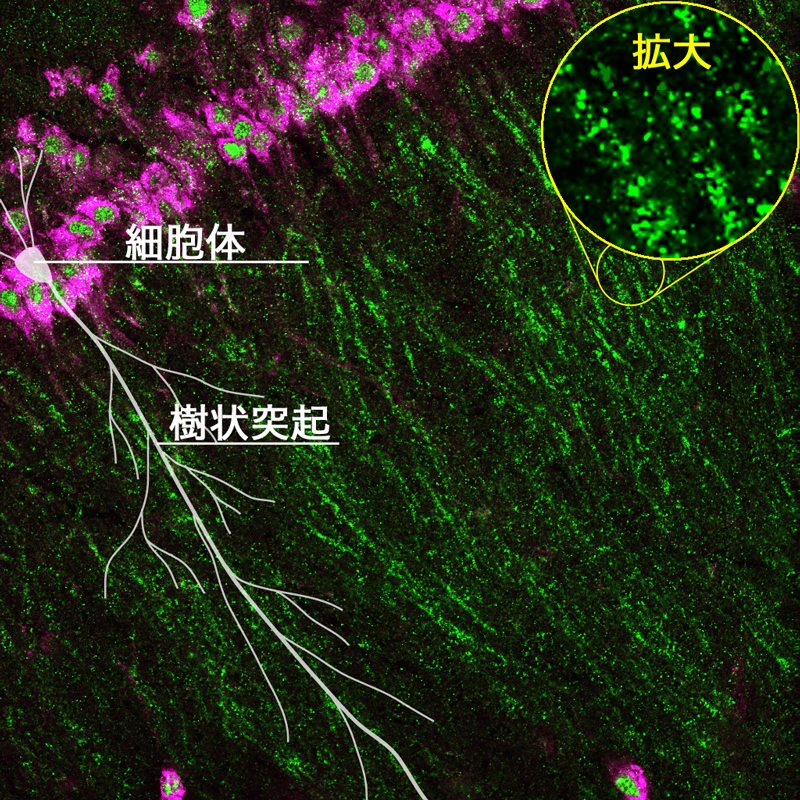
マウス脳海馬ニューロンのRNA顆粒
ニューロンの細胞体(赤)から伸びた樹状突起にRNA顆粒(緑)が輸送され、局在している。模式図(白)はニューロンの細胞体とそこから伸びた樹状突起。
細胞小器官の多くは膜によって区画化されるが、近年、膜に包まれずに区画化される「コンデンセート」と呼ばれる細胞小器官の存在が明らかになってきた。コンデンセートは液-液相分離によって形成され、特定の分子が濃縮される。RNA顆粒もコンデンセートの一種であり、特定のRNA結合タンパク質、mRNA、リボソームなどが濃縮されている。RNA結合タンパク質の中には、三次元構造をとらない天然変性領域(IDR)を持つものがあり、これらの弱い相互作用が液-液相分離の駆動力となっている。さらに、IDRを持つタンパク質は、量的変化や翻訳後修飾変化を受けることで、他の分子の濃縮や排除を調節したり、RNA顆粒の状態を液相からゲル・固相に転移させたりする。筋萎縮性側索硬化症や前頭側頭型認知症などの神経変性疾患の原因タンパク質であるFUSやTDP-43もIDRを持ち、疾患ではRNA顆粒に集積し、RNA顆粒の動態を撹乱すると考えられている(図1)。私たちは、IDRを介したRNA顆粒の形成・動態制御の分子機構を明らかにすると共に、学習、加齢、ストレス、疾患などの内的・外的要因がRNA顆粒の動態に与える影響や、それが神経機能の調節や異常にどう関わるかを研究している。現在は特に、学習によって翻訳活性が上昇する際にRNA顆粒が示す動態変化と、その分子メカニズムに注目している。
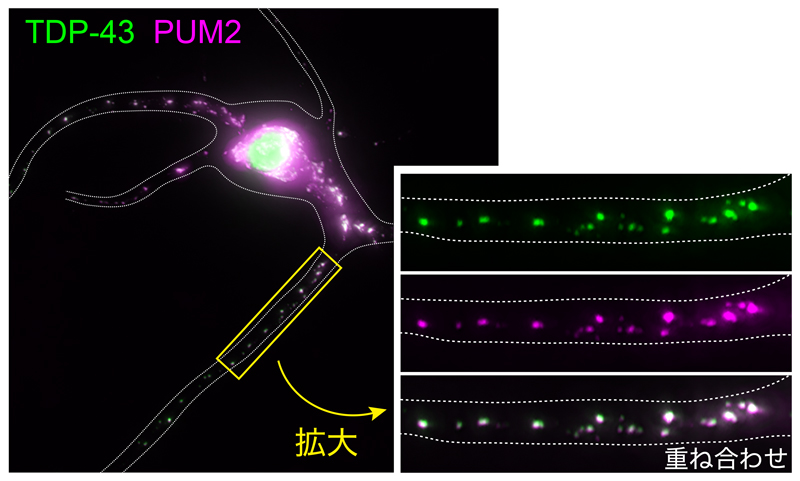
図1. ニューロン樹状突起のRNA顆粒に集積するRNA結合タンパク質
培養ニューロンの樹状突起においてPUM2(赤)はRNA顆粒を形成する。TDP-43(緑)は通常は核内に存在するが、神経変性疾患ではRNA顆粒に集積する。点線はニューロンの輪郭を示す。樹状突起の拡大図を右側の写真に示す。
ニューロンにおけるRNA顆粒の重要な役割は、mRNAを樹状突起へ輸送し、学習時のシナプス入力に応じて後シナプス(スパイン)近傍で局所翻訳を引き起こすことである。この局所翻訳はシナプス結合の長期的な強化に必要であり、長期記憶の形成に関与すると考えられている。私たちは、RNA顆粒を構成する因子が局所翻訳や学習・記憶形成に果たす役割の解明に取り組んでいる。例えば、RNG105(別名caprin1)は、IDRを持ち、mRNAの樹状突起への輸送を担うRNA結合タンパク質である。RNG105欠損マウスでは、本来樹状突起に局在すべき多様なmRNAの局在が低下し、欠損が軽度の場合には自閉症様行動を、重度の場合には長期記憶の著しい低下を引き起こす(図2)。今後は、RNA顆粒の状態変化をIDRを介して制御する他の因子が、長期記憶形成にどのように関与しているかを明らかにしたいと考えている。
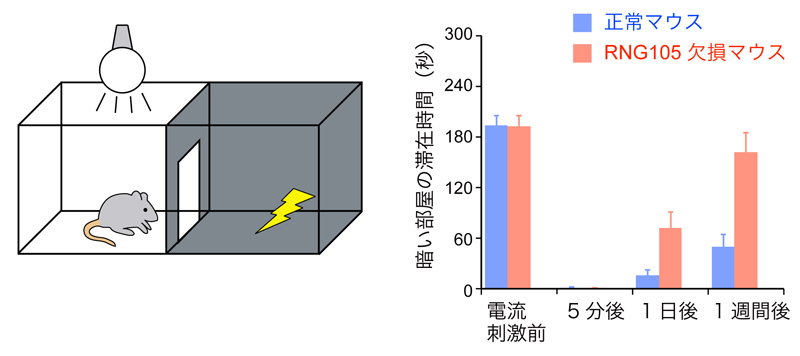
図2. RNG105遺伝子欠損による長期記憶の低下
マウスは暗い部屋で電流が流れる不快な経験を学ぶと、その後電流が流れなくても暗い部屋を避けるようになる。正常マウスは1週間後も暗い部屋を避けた。一方、RNG105欠損マウスは5分後には暗い部屋を避けたものの、1週間後にはほぼ元通り暗い部屋に進入した。
本研究室では、大学院生を募集しています。
椎名 伸之 准教授 E-mail: nshiina@nibb.ac.jp
