
基礎生物学研究所




多細胞生物は受精卵から細胞分裂を繰り返し体づくりを行います。卵割で増えた細胞はその位置によって性質を変えていきます。体のパターンを作るシグナル分子の産生と消去は発生の時間的制約の中で“ここぞ”というタイミングで行われなくてはなりません。シグナル分子を作る細胞がプログラム細胞死で速やかに除去されることでこの切り替えを可能にしています。また、発生では細胞分化に失敗する細胞も多数出現しますが、そのような細胞は速やかに生体から除去されます。せっかく作った細胞を失う仕組みが、体を作っていく創造的なプロセスの中に巧みに組み込まれているのです。発生が完了すると、体は急速に成長し性的成熟を迎えて子孫を残せるようになります。しかし、この状態が長く続くわけではありません。生物は最大寿命を超えて生きることはできないのです。生物は環境や傷害に巧みに応じて生命を維持しますが、その生物応答に発生や成長を一次的に止める休眠現象も知られています。私たちは細胞死や老化、休眠といった細胞活力を低下させる仕組み解明することで、生物個体が持つ活力制御の理解を深めたいと考えています。
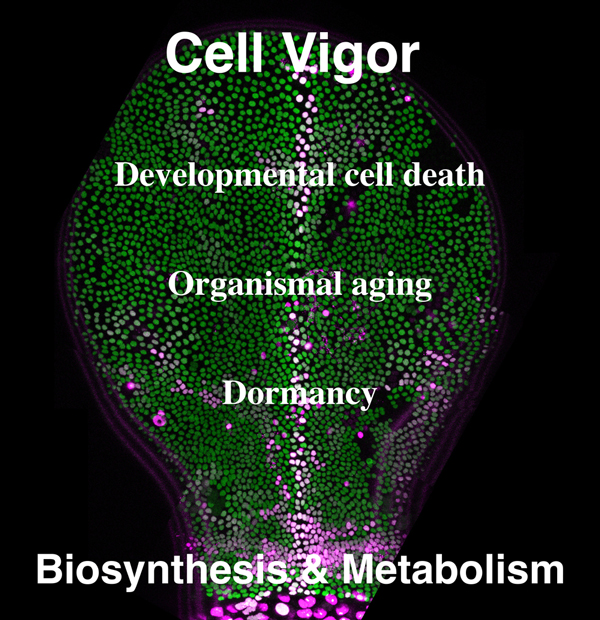
ショウジョウバエ変態期の胸部閉鎖時におこる正中線でのカスパーゼ活性化
ショウジョウバエ変態期におこる胸部閉鎖では左右の上皮が融合する正中線でカスパーゼの活性化を伴う細胞脱落が起きます。この細胞脱落は閉鎖速度の調節に関わっています。
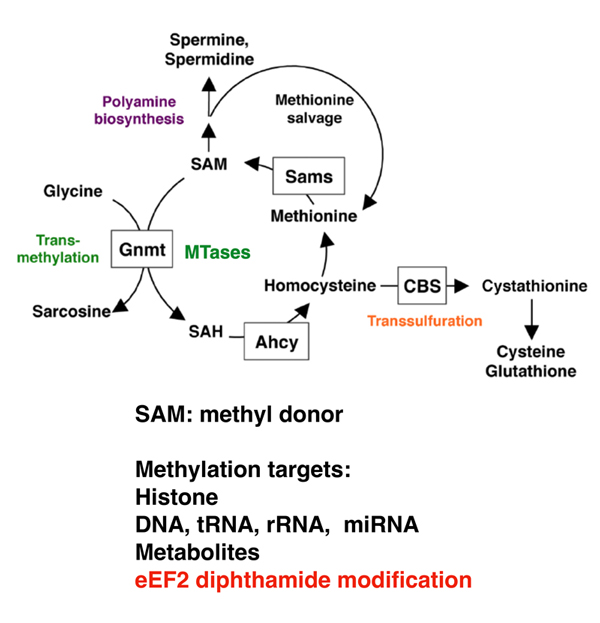
図1.メチオニン/SAM代謝経路
ショウジョウバエ腸上皮傷害や飢餓ストレスからの回復時には腸幹細胞の増殖が起こる。この再生現象にSAMは必須の代謝産物である。SAMを利用するメチル基転移酵素を遺伝学的にスクリーニングした結果、翻訳伸長因子eEF2だけに見られるジフタミド修飾酵素Dph5が得られた。ジフタミド修飾は7〜8種類の酵素を用い、5つのSAMを利用する複雑な化学修飾であり、翻訳伸長因子eEF2にだけ起こることが知られている。この化学修飾の生理機能は不明な点が多く、腸幹細胞の増殖時における翻訳には必須な働きをするが、翻訳への働きが不明な細胞も多く知られている。ジフタミド修飾は真核生物全てに保存されていることから、未だ知られていない重要な生理機能を有すると考えられる。さまざまな生物における、発生、細胞死、細胞ストレス、老化、休眠におけるジフタミド修飾の役割を明らかにする。
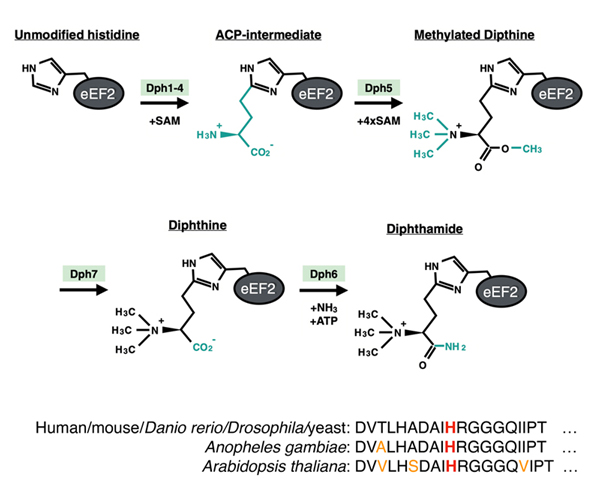
図2. eEF2のヒスチジンにおこるジフタミド修飾反応(文献3から)
修飾部位の配列は種間での保存性が高い
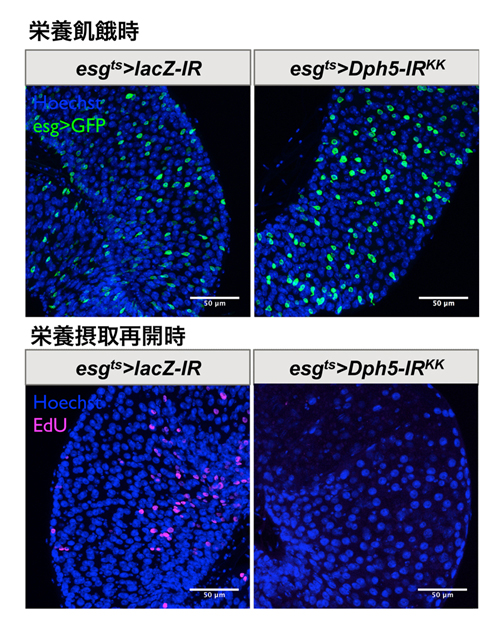
図3. 腸幹細胞・腸芽細胞でジフタミド修飾に必要なメチル基転移酵素Dph5をノックダウンすると腸幹細胞の再増殖が阻害される(文献4から)