
基礎生物学研究所




マメ科植物は根粒菌と相互作用することで、感染糸の形成と皮層細胞の分裂を誘導し、「根粒」と呼ばれる窒素固定器官を形成します。一方、アーバスキュラー菌根菌(AM菌)は多くの陸上植物と共生し、生育に必要なリンや水分を効率よく吸収するとともに光合成産物を菌体に貯留します。近年、マメ科植物の根粒共生は、 4 億年よりも前に誕生したAM菌との共生システムを基盤として、進化してきたことが明らかになってきました。私たちは、日本に自生するマメ科モデル植物ミヤコグサと根粒菌やAM菌を用いて、陸上生態系を支える2つの共生系の分子機構と進化の解明を目指しています。さらに、未だ謎に包まれているAM菌類の特性を明らかにするために、AM菌の非共生培養や形質転換技術の開発にも取り組んでいます。
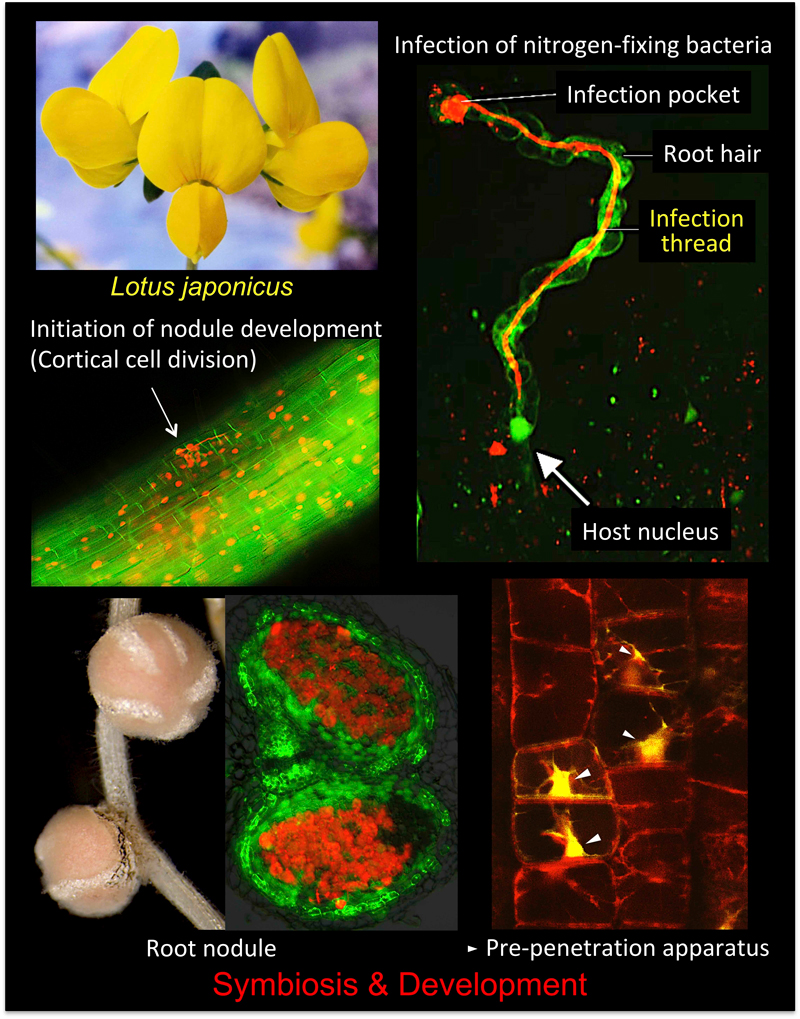
多くのマメ科植物に見られる根粒では、大気中の窒素分子は常温常圧で効率よくアンモニアへと変換される。根粒菌が根に感染すると、数日以内に感染糸を介して細胞内に取り込まれ、窒素固定オルガネラ(バクテロイド)へと変化する。(図1)。
私たちは、マメ科のモデル植物ミヤコグサを用いて、包括的な共生変異体の単離を行い、根粒菌の感染や窒素固定、根粒形成の全身制御に関わる原因遺伝子を特定している。興味深いことに、根粒形成のごく初期に関わる遺伝子の多くは、AM菌との共生にも必須であった(赤字で示した遺伝子)。原因遺伝子の機能を解明することで、2つの共生系の分子メカニズムの解明を目指している。
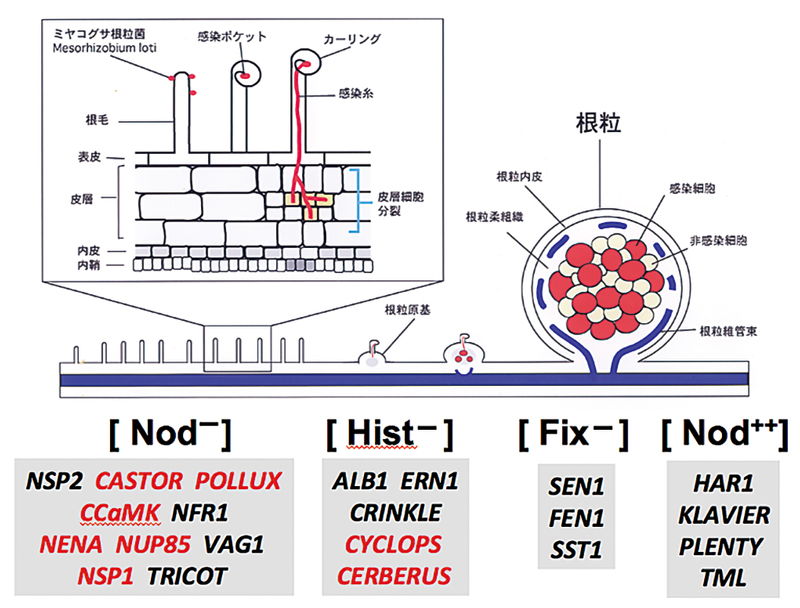
図 1. 根粒形成過程の概要と根粒共・菌根共生に必要な宿主遺伝子
共生窒素固定は多くの生体エネルギーを消費するため、マメ科植物は根粒の数を適切に制御している。私たちは、ミヤコグサの根粒過剰着生変異体を用いて、根粒数が根と葉の遠距離コミュニケーションによって制御される分子メカニズムを解明してきた。これまで、根から葉へと遠距離移動する糖修飾されたCLEペプチド、その受容体であるHAR1、HAR1によって制御され葉から根へと長距離移動するマイクロRNA(miR2111)やサイトカイニン、シュート由来のシグナルを根で受けるTML等を特定してきた。現在、全身的なフィードバック制御の全容解明を進めている(図2)。また、植物が「根」における感染や窒素情報をあえて「葉」に送る生物学的意義は不明であり、一次代謝制御の観点から研究を進めている。
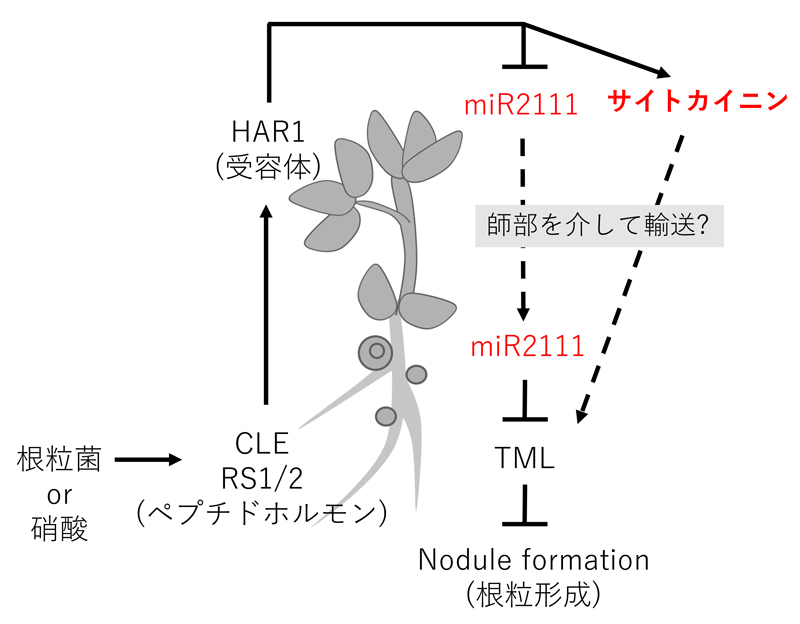
図 2. 「根」と「葉」の遠隔シグナル伝達を介した根粒形成の全身制御モデル
根粒共生とAM共生では、初期応答に関わる遺伝子が共通していることから、マメ科植物は多くの陸上植物に保存されるAM共生の遺伝子を基盤として、根粒共生を進化させたと考えられる。通常、植物は側根を発達させることで土壌中の限られた養分を効率よく吸収している。最近、根粒共生に特異的な転写因子の下流で、側根の発達に関わる遺伝子が根粒の形成に流用されていることが分かってきた。さらにオーキシンのメチル化やサイトカイニン応答の振動が重要であることもわかってきた。AM共生に必要な宿主因子を基盤として、どのような因子や制御系が獲得されたかを探ることで、根粒共生の進化を解明することを目指している。
AM菌は宿主植物に感染しないと増殖できない絶対共生菌であり、多核性や1個体内でrDNA多型を示すなど興味深い特徴を持つ。しかし、AM菌の生物学的性質は未解明の部分が多く、共生の分子機構も不明である。私たちは、AM 菌の特性解析や非共生培養技術、形質転換技術の開発に取り組んでいる。
川口 正代司 教授 E-mail: masayosi@nibb.ac.jp
