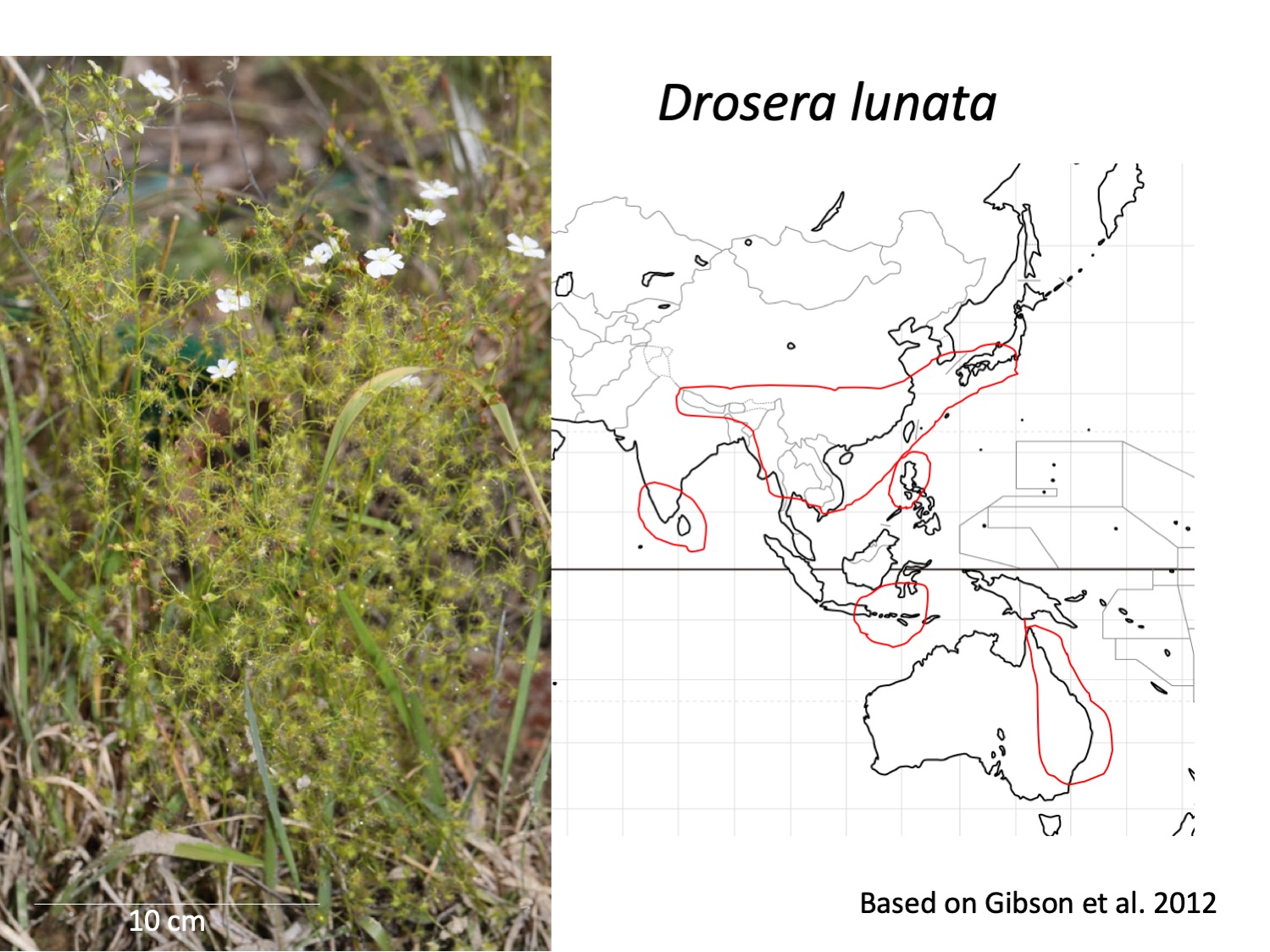
イシモチソウ複合種群Drosera peltata complexは日本から西に韓国、中国、インドシナ、スリランカ、インド、ヒマラヤへ、南にはフィリピン、インドネシア、オーストラリア、ニュージーランドに分布する(Gibson et al. 2012)。しかし、分類は十分に行われておらず、日本とヒマラヤでD. peltataの学名をあてられているイシモチソウは、オーストラリアのD. peltataと形態が異なるなどの指摘がされてきた(Hara 1966)。Gibson et al. (2012)は形態形質を比較して、オーストラリアのイシモチソウ複合種群を整理するとともに、従来D. peltataと考えられてきたインドネシアから東アジアへと分布する種は、D. lunataであると発表した。日本のイシモチソウには、従来Drosera peltataの学名があてられることが多かったが、Drosera lunataが妥当だろうという論文である。
The Drosera peltate complex is distributed from Japan, Korea, China, Indochine, Sri Lanka, India, the Himalayas, the Philippines, Indonesia, Australia, and New Zealand (Gibson et al. 2012). Gibson et al. (2012) compared morphological traits among the Drosera peltate complex and classified into five species. The species distributed outside of Australia and New Zealand, which had been recognized as Drosera peltate, was identified as D. lunata.

これは、Gibson et al. (2012)のイシモチソウ複合種群の検索表である。D. peltataはガク片に毛があるが、日本のイシモチソウには無い。従って、D. peltataではない可能性が高い。一方、オーストラリアのD. lunataは萼片が無毛である点が、日本のイシモチソウと同じである。
This is a key of the D. peltata complex from Gibson et al. 2012. D. peltata is defined to have hairs on sepals but Japanese species does not. Therefore, the Japanese species is not likely to be D. peltata. On the other hand, D. lunata from Australia has hairless sepals, which are the same as those in Japanese species.

愛知県春日井市に自生するイシモチソウの花を観察すると、萼片背側(A、B)には多数の腺細胞(C、D)があるが、毛は生えていない。萼片向軸側(E、F)は毛も腺細胞も無く、平滑である。Gibson et al. (2012)は、D. lunataの萼片形態として、「萼片は全縁から細鋸歯縁、あるいは、細鋸歯状から部分的に0.6 mmまでの長縁毛が生える」と記載している。観察したイシモチソウでは、辺縁は細鋸歯状となり、さまざまな長さの長縁毛が形成される。長縁毛は、長いもので約0.4 mmある。従って、これらの形質は、Gibson et al. (2012)の記載の範囲に入っている。
Sepals of D. lunata collected in Kasugai City, Aichi Prefecture, Japan are glabrous with many unicellular glands on the abaxial side (A-D) but not on the adaxial side (E, F). Gibson et al. (2012) mentions “with the margin entire to serrulate, or denticulate, to partially to fully fimbriate with hairs up to 0.6mm long” for the sepals of D. lunata. The D. lunata has characters in this range.

春日井市のイシモチソウの塊茎表面は、白色である。Gibson et al. (2012)のD. lunataの記載には赤から白と記載があり、その範疇に入っている。日本のイシモチソウは、ここまで見てきた萼片形態と塊茎表面の色に加え、葉形態、花形態などもGibson et al. (2012)のD. lunataの範疇に入っており、現状では、D. lunataという学名が妥当であると考えられる。
一方で、D. lunataは広域分布することから、地域間で遺伝的交流が遮られ、地域集団や隠蔽種が形成されている可能性がある。萼片形態と塊茎表面の色で見たように、D. lunataの形態変異の範囲は大きい(Gibson et al. 2012)。一方で、日本のイシモチソウの萼片形態を中国の個体(Lu and Kondo 2001)の萼片形態と比較すると互いに類似しているが、オーストラリアの個体(Lowrie 2013)は萼片がほぼ全縁で先端部分に細鋸歯を持つ点で異なっている。Lu and Kondo (2001)に塊茎表面の色の記載は無いが、オーストラリアの個体は赤色であり、日本の個体が白色であるのと異なっている(Gibson et al. 2012、Lowrie 2013)。
The surface of the tuber of the D. lunata in Kasugai is white. That in D . lunata sensu Gibson et al. (2012) is described to be red to white, and the surface color of Japanese D. lunata falls into the described characters. As well as the sepal morphology and tuber surface color, leaf and flower morphology is not distinguished Japanese D. lunata and D. lunata sensu Gibson et al. (2012). Therefore, at present, D. lunata should be an appropriate scientific name for the Japanease species.
On the other hand, the widespread distribution of D. lunata may interrupt genetic exchanges between regions, which can lead to regional populations and cryptic species. The range of morphological variation in D. lunata is large, as seen in calyx morphology and tuber surface color (Gibson et al. 2012). While the sepal morphology of Chinese D. lunata (Lu and Kondo 2001) is similar to Japanese one, they are different from Australian plants (Lowrie 2013), having entire leaf margin with a slightly serrated tip. The surface color of tuber in Australian D. lunata is in red, which is diffenret from that in Japanese one (Gibson et al. 2012, Lowrie 2013). The surface color in Chinese species is not describe in Lu and Kondo 2001.
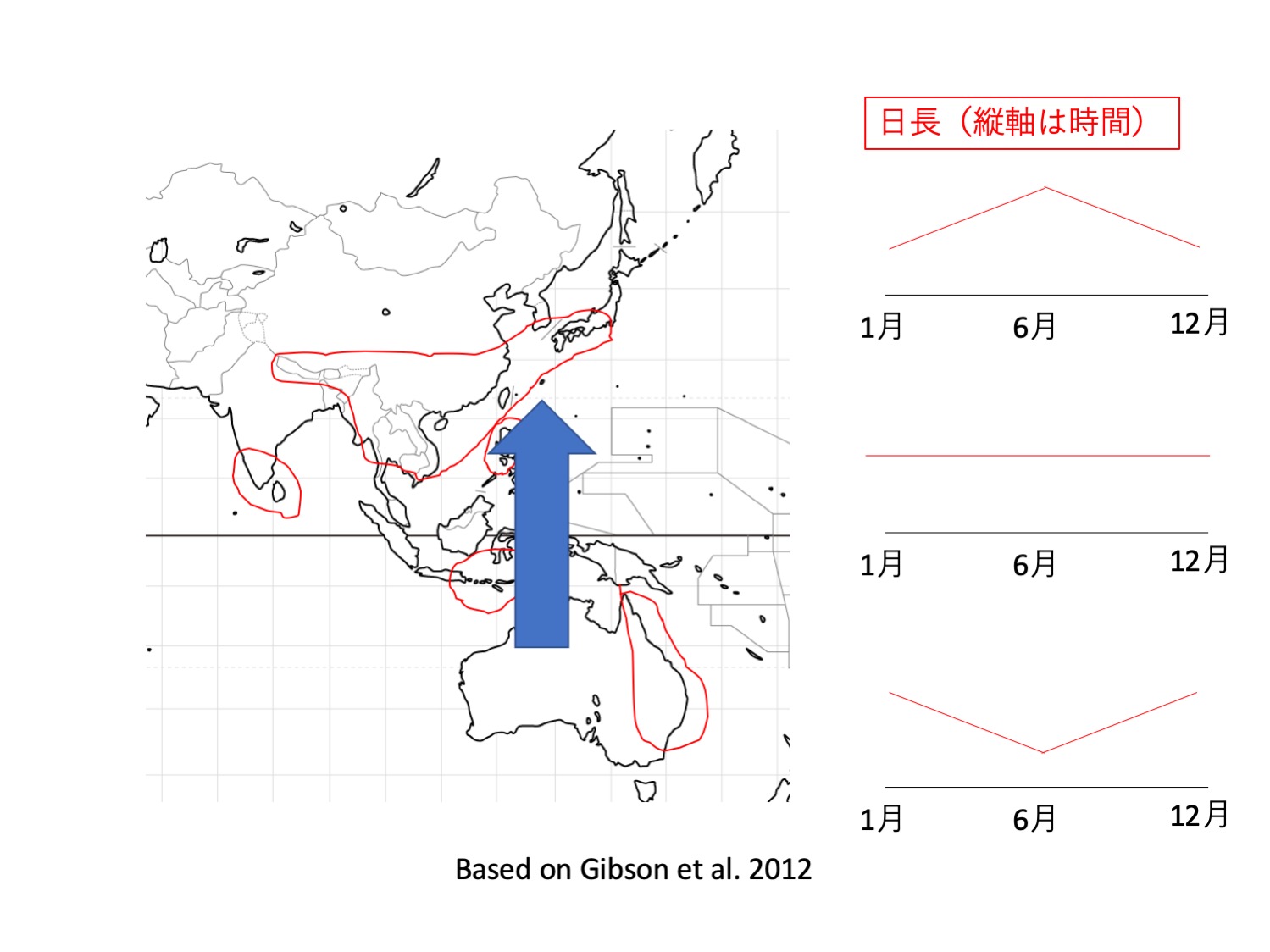
イシモチソウ複合種群含む、塊茎を持つモウセンゴケの仲間で、赤道を越えて北半球にまで分布を広げているのはD. lunataだけである。オーストラリアでは、立ち上がるシュートを形成する塊茎性モウセンゴケは、早春に発芽し、春から夏(8から11月頃)に開花することから(Lowrie 2013)、開花は長日で誘導されると推測される。一方、D. lunataは、夏期に湿った場所で生育し、秋から春にかけて開花することが多く、他種と異なっている(Gibson et al. 2012)。このことから、長日性を失っている可能性がある。さらに、Gibson et al. (2012)は、世界各地の標本を調べると、開花時期がさまざまであると記述しており、長日性を失っている可能性を支持している。長日性を失えば、日長変化の無い熱帯域での開花を介した有性生殖が可能となる。これらのことから、D. lunataは花芽形成の制御機構に変異がおこることで、熱帯域という中日条件での繁殖を可能として、北半球へと分布を広げることを可能にしたのではないかという仮説をたてることができる。南北半球と熱帯域に分布するD. lunataを、異なった日長下で比較栽培し、日長と花芽誘導の関係を調べればこの仮説を検証できるだろう。植物は日長を利用して開花時期や休眠時期を最適化しているとともに、それが種形成の原動力にもなっている(Serrano-Bueno et al. 2017、Gaudinier and Blackman 2020)。一方で、このことは、分布を広げる制約となっている。これらの要因の兼ね合いによって、多様な植物の分布が生み出されていると考えられる。
In tuberous Drosera species including D. peltata comples, only D. lunata expanded its distribution to the northern hemisphere across the equator. Tuber Drosera species with erect leafy shoots start to grow from dormant tubers in early spring after the dormancy starting from dry summer. They bloom in spring to early summer (August to November), suggesting that flowering is induced by long days. D. lunata, on the other hand, grows in wet areas during the summer months and often blooms in the fall and spring , different from other species (Gibson et al. 2012). This suggests that D. lunata may have lost its long-day nature. Furthermore, Gibson et al. (2012) examined specimens from around the world and found that the flowering season is variable, which supports the hypothesis. Loss of long-day nature would allow sexual reproduction via flowering in the tropics, where there is mostly no change in daylength. These results suggest that D. lunata may be able to reproduce sexually via flowering in the equatorial region by mutations in flowering genes. Plants use day length to optimize flowering and dormancy times, which sometimes functions in speciation (Serrano-Bueno et al. 2017, Gaudinierand Blackman 2020). On the other hand, this is a constraint on expanding the distribution. The combination of these factors is likely to produce a diverse distribution patterns of plants.
 イシモチソウの塊茎(白矢印)は5〜10センチの深さにある。茎が伸びた頃には今年の球茎は黒く枯れている。茎の地下部の鱗片葉の葉腋両側(赤矢印)と鱗片葉の外側(紫矢印)から不定根が出る。なぜこの位置から出るかはわからない。
イシモチソウの塊茎(白矢印)は5〜10センチの深さにある。茎が伸びた頃には今年の球茎は黒く枯れている。茎の地下部の鱗片葉の葉腋両側(赤矢印)と鱗片葉の外側(紫矢印)から不定根が出る。なぜこの位置から出るかはわからない。
The tuber of D. lunata is in 5 to 10 cm depth. By the time the stem has grown, this year’s tuber turns black and mostly dead. The adventitious roots emerge from both sides of the leaf axils (red arrows) and from the adaxial side of the base of scale leaves (purple arrows).

6月初旬に、塊茎の黒い皮をむくと収縮して黒くなった塊茎(白矢印)と白い塊茎があった。
In early June, the black skin of the tuber was peeled back to reveal a shrunken, blackened tuber (white arrow) and a white tuber.

黒く縮んだ塊茎は今年の塊茎で、ここから地上シュートが伸長している(白矢印線。矢印方向が先端)。一方、地上シュートの基部の葉(*)の腋から鱗片葉のみからなる側枝が伸長し(赤矢印線)、肥大することで、白い塊茎、すなわち、来年の塊茎を形成する。
The black, shrunken tuber is this year’s tuber, from which the above-ground shoot grows (white arrow line. The arrow direction is the tip). On the other hand, a lateral branch subtending only scale-leaves extends from the axils of a scale-leaf (*) at the base of the above-ground shoot (red arrow line) and it forms a white tuber, i.e., next year’s tuber.
 側枝の茎はほとんど伸長せず、小さな鱗片状の葉が形成される(点線)。前図のように、最初、側枝の茎頂は下向きに出るが、途中で向きが反転して、地上側を向く。茎頂部分(矢印)には多数の鱗片葉が形成される。白星印は今年の塊茎の付いていた位置で、周辺に赤みがかった鱗片葉が見える。
側枝の茎はほとんど伸長せず、小さな鱗片状の葉が形成される(点線)。前図のように、最初、側枝の茎頂は下向きに出るが、途中で向きが反転して、地上側を向く。茎頂部分(矢印)には多数の鱗片葉が形成される。白星印は今年の塊茎の付いていた位置で、周辺に赤みがかった鱗片葉が見える。
The stem of the lateral branch barely elongates, and small scaly leaves are formed (dotted lines). As shown in the previous figure, the shoot apex of the lateral branch initially grows downward, but the direction reverses midway and faces toward the ground. Numerous scale leaves are formed at the stem apex (arrow). The white star indicates the position where this year’s tuber was attached, and reddish scale leaves can be seen in the vicinity.
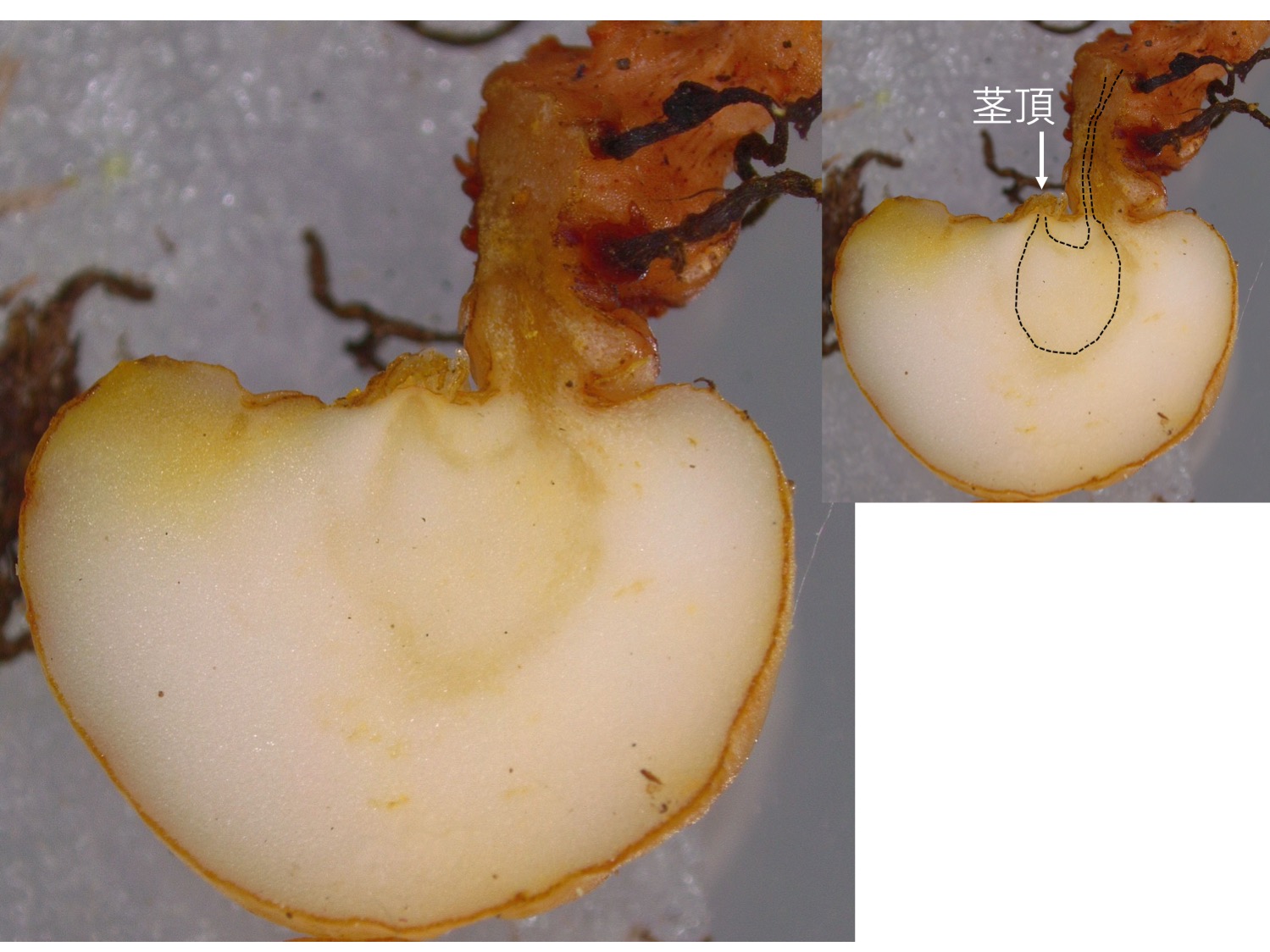 塊茎を縦割りにすると、維管束(黒点線)がU字型になり、茎頂が途中から上を向いているのがわかる。
塊茎を縦割りにすると、維管束(黒点線)がU字型になり、茎頂が途中から上を向いているのがわかる。
When the tuber is longitudinally cut, the vascular bundle (black dotted line) is observed to be in U-shape, which indicates that the shoot apex changed the growth directions.
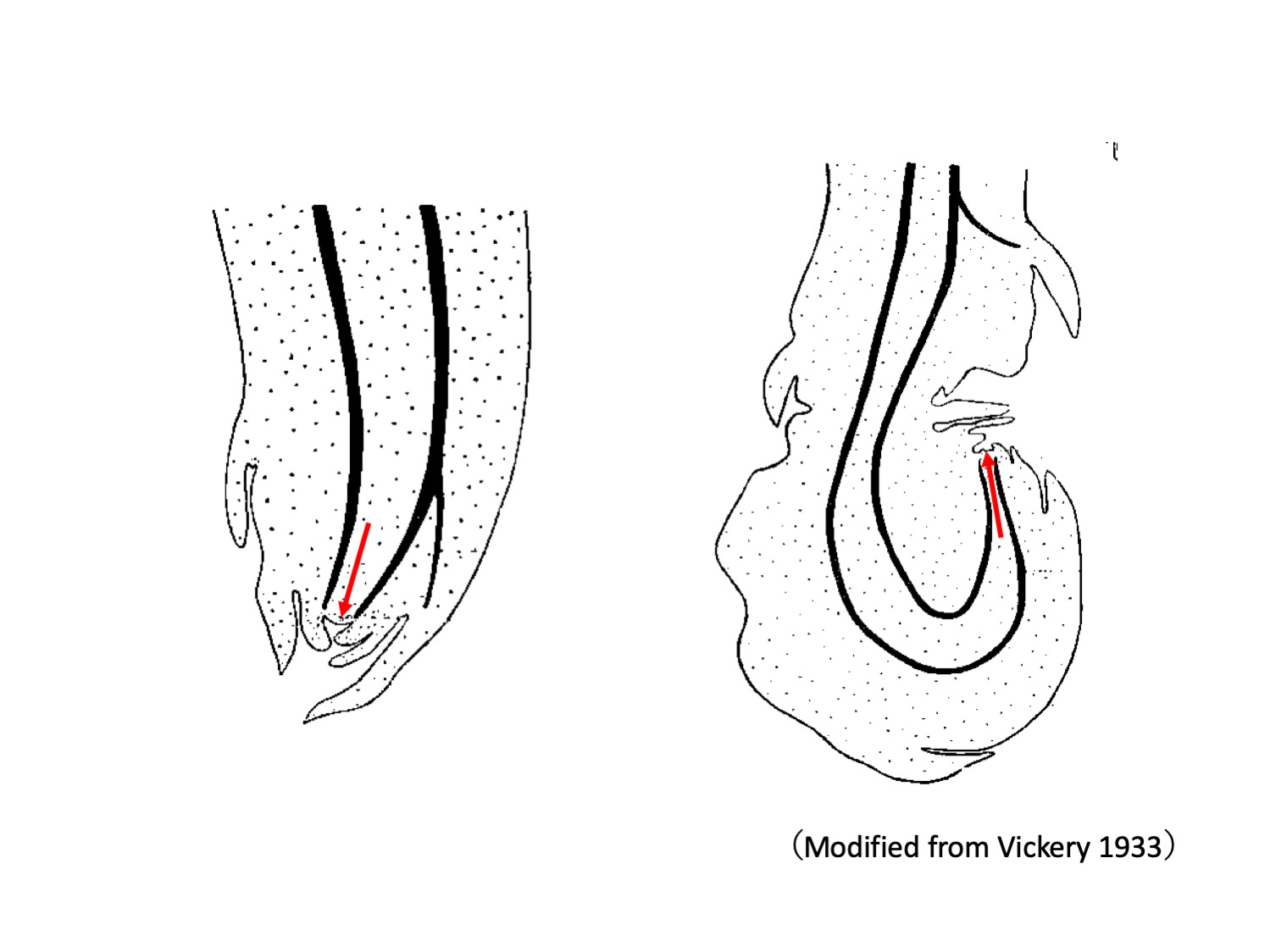 Drosera peltata sensu Vickery 1933では、来年の塊茎以外に、地上シュートの地上部基部や地下部の鱗片葉腋から、ドロッパーdropperと呼ばれる、数センチほど伸長する側枝が形成される(Vickery 1933)。ドロッパーは最初は下方に向かって伸び(左図、赤矢印は茎頂分裂組織、黒線は維管束を示す)、地中をしばらく伸長した後、茎頂が上方に向かって曲がることで側枝(ドロッパー)先端に塊茎ができる(右図)。
Drosera peltata sensu Vickery 1933では、来年の塊茎以外に、地上シュートの地上部基部や地下部の鱗片葉腋から、ドロッパーdropperと呼ばれる、数センチほど伸長する側枝が形成される(Vickery 1933)。ドロッパーは最初は下方に向かって伸び(左図、赤矢印は茎頂分裂組織、黒線は維管束を示す)、地中をしばらく伸長した後、茎頂が上方に向かって曲がることで側枝(ドロッパー)先端に塊茎ができる(右図)。
In D. peltata sensu Vickery 1933, aerial lateral branches called droppers are formed from axils of cauline leaves (Vickery 1933). Droppers grow downwards (left drawing) and enter into the soil. After a period of elongation in the ground, the stem apex bend upward to form a tuber (right drawing).
 Drosera lunataでは、地上茎からはドロッパーは形成されないが、地下の鱗片葉から複数のドロッパーが形成され、今年の塊茎の回りに複数の来年の塊茎が形成される。自生地では、何本かがかたまって生えている場合が多いが、これらはドロッパーによる栄養繁殖で増えたと考えられる。
Drosera lunataでは、地上茎からはドロッパーは形成されないが、地下の鱗片葉から複数のドロッパーが形成され、今年の塊茎の回りに複数の来年の塊茎が形成される。自生地では、何本かがかたまって生えている場合が多いが、これらはドロッパーによる栄養繁殖で増えたと考えられる。
Drosera lunata does not form droppers on the aerial shoots but form from the axils of underground scale leaves. Since multiple droppers are formed to be next year’s tubers, several plants grow in clumps.
 オーストラリアに分布する塊茎を持ち地上茎が伸長する種群では、地上茎基部の葉が葉身を形成するか、形成せずに鱗片状になるかが、種を区別する重要な形質となっている。一方、D. lunataでは、基部に葉間の短いロゼット葉を数枚形成する個体と、葉身の無い鱗片状の葉を数枚形成する個体が混在している。どうしてこのような違いが生じるのかはわかっていない。
オーストラリアに分布する塊茎を持ち地上茎が伸長する種群では、地上茎基部の葉が葉身を形成するか、形成せずに鱗片状になるかが、種を区別する重要な形質となっている。一方、D. lunataでは、基部に葉間の短いロゼット葉を数枚形成する個体と、葉身の無い鱗片状の葉を数枚形成する個体が混在している。どうしてこのような違いが生じるのかはわかっていない。
In Australian tuber Drosera with erect stems, leaf organization at the base of aerial shoots is a critical diagnostic character, although there are some variations: the existence of rosette leaves, the number of scale leaves, and so on. In D. lunata, some plants form rosette leaves at the base of the aerial shoots, while others growing in proximate distances form scale leaves instead rosette leaves. The regulatory mechanisms to form different types of leaves are unknow in D. lunata.
地上シュートの基部のロゼット葉(B)と地上シュートのそれ以外の葉(A)では形態が異なっているが、この違いを司る機構は不明である。
The morphology of the rosette leaf at the base of the aerial shoot (B) differs from that of the rest of the ground shoot (A), but the mechanism responsible for this difference is unknown.

訪花昆虫は花粉を媒介することで、多くの被子植物の有性生殖に寄与している。しかし、食虫植物は昆虫を捕食するので、訪花昆虫を捕獲すると花粉媒介にデメリットになるというジレンマ、即ち、送粉者-獲物相反pollinator–prey conflictを抱えている。この相反を回避するため、長い花茎を形成し、花を捕虫葉から離すことで、送粉昆虫を捕獲してしまわないようにしているのではないかと考えられてきた (Ellison and Gotelli 2001, Ellison et al. 2003, Givnish 1989, Juniper et al. 1989)。実際、ハエトリソウやモウセンゴケの仲間の多くは長い花序を形成する。
Flower-visiting insects contribute to the sexual reproduction of many angiosperms by mediating pollen. However, since carnivorous plants prey on insects, capturing visiting insects is a disadvantage to pollen vectors. The dilemma is called pollinator-prey conflict. It has been hypothesized that to avoid this conflict, long inflorescence stalks are formed not to capture pollinating insects (Ellison and Gotelli 2001, Ellison et al. 2003, Givnish 1989, Juniper et al. 1989). In fact, many members of Drosera and its sister genus Dionaea form long inflorescences.

そこで、Anderson (2010)は同所的に自生する、長い花茎を伸長させロゼット状の捕虫葉と花の距離が離れているDrosera paucifloraと、捕虫葉と花が近接して形成されるDrosera cisfifloraで、送粉昆虫が捕獲され割合を比較した。しかし、両者ともに、送粉昆虫はほとんど捕食されていなかった。このことから、長い花茎は、他の非食虫植物と同じように、訪花昆虫を獲得し、種子をより遠くに飛ばすための適応であり、送粉者を捕食しないためではないと結論づけた。
Then, Anderson (2010) compared D. cistiflora forming flowers close to trap leaves and D. pauciflora with a long scape, both of which grow in close proximity. Pollinators were rarely captured in trap leaves in both species and Anderson (2010) concluded that the long scape is adaptive to attract pollinators and to disperse seeds in Drosera as in other non-carnivorous plants, but not to trap pollinators in their carnivorous leaves.

イシモチソウ複合種群では、花が捕虫葉にかなり近接している。El-Sayed et al. (2016)はDrosera auriculataの花と捕虫葉から放出される昆虫誘引物質を解析し、花の誘引物質は訪花昆虫を呼び寄せるが、葉の誘引物質は呼び寄せないことを発見した。このことから、イシモチソウでも花と捕虫葉で別々の化学物質を作って、異なった昆虫を誘引している可能性がある。
Flowers of D. peltata complex species are formed in fairly close proximity to trap leaves. In D. auriculate, El-Sayed et al. (2016) showed that the chemicals released from the flowers and the trap leaves are different and may attract different insects not to make pollinators be attracted to trap leaves.

一方、イシモチソウは自家受粉で結実できる。多くの花にアザミウマが花粉を食べに来ていたが、アザミウマが移動することで、自家受粉が行われていた。イシモチソウの他花受粉と自家受粉の割合、アザミウマ以外の送粉昆虫の種類、アザミウマと他の送粉者の送粉への寄与の割合はわかっていない。
謝辞 イシモチソウの観察は、名城大学森田裕将博士、基礎生物学研究所星野敦博士に材料を提供していただきました。心より感謝申し上げます。
D. lunata can be self-pollinated. Thysanoptera insects were often observed in flowers to eat pollen, which function in self-pollination.
I deeply appreciate Drs. Yasumasa Morita in Meijo University and Atsushi Hoshino in National Institute for Basic Biology for providing D. lunata and stimulating my curiosity.
引用文献 References
Anderson, B. (2010). Did Drosera evolve long scapes to stop their pollinators from being eaten? Ann. Bot. 106, 653–657.
Ellison AM, Gotelli NJ. Evolutionary ecology of carnivorous plants. TREE. 2001;16:623–629.
Ellison AM, Gotelli NJ, Brewer JS, et al. The evolutionary ecology of carnivorous plants. Advances in Ecological Research. 2003;33:1–74.
El-Sayed, A.M., Byers, J.A., and Suckling, D.M. (2016). Pollinator-prey conflicts in carnivorous plants: When flower and trap properties mean life or death. Sci. Rep. 6, 21065.
Gaudinier, A., and Blackman, B.K. (2020). Evolutionary processes from the perspective of flowering time diversity. New Phytol. 225, 1883–1898.
Givnish TJ. Ecology and evolution of carnivorous plants. In: Abrahamson WG, editor. Plant–animal interactions. New York: McGraw-Hill Inc; 1989. pp. 243–290.
Gibson, R., Conn, B.J., and Bruhl, J.J. (2012). Morphological evaluation of the Drosera peltata complex (Droseraceae). Aust. Syst. Bot. 25, 49–80.
Hara, H. (1966) The flora of the eastern Himalaya: results of the botanical expedition to eastern Himalaya organized by the University of Tokyo 1960 and 1963. Univ. Tokyo Press, Tokyo.
Juniper, B.E., Robins, R.J., and Joel, D.M. (1989). The Carnivorous Plants (London, Uk: Academic Press).
Lowrie, A. 2013. Carnivorous Plants of Australia Magnum Opus Vol. 1. Poole, Dorset, UK: Redfern Natural History Productions.
Lu, L. and Kondo, K. 2001. Droseraceae. In Wu, Z.Y. and Raven, P.H. eds. Flora of China Vol. 8. pp. 199-201.
Serrano-Bueno, G., Romero-Campero, F.J., Lucas-Reina, E., Romero, J.M., and Valverde, F. (2017). Evolution of photoperiod sensing in plants and algae. Curr. Opin. Plant Biol. 37, 10–17.
Vickery, J.W. (1933). Vegetative reproduction in Drosera paltata and D. auriculata. Proc. Linn. Soc. New South Wales 58, 245–250.






















 他の種子植物と異なり、第二葉は出ない。第一葉に平行な位置に、茎頂分裂組織を挟むように2枚の鱗片体が形成される(Pham and Sinha 2003)。第二葉は第一葉と平行に形成されることは無いので、鱗片葉は第二葉と相同ではない。鱗片葉が他の植物のどのような器官と相同なのか、どのような発生機構によって生じ、進化したのかはわかっていない(Pham and Sinha 2003)。
他の種子植物と異なり、第二葉は出ない。第一葉に平行な位置に、茎頂分裂組織を挟むように2枚の鱗片体が形成される(Pham and Sinha 2003)。第二葉は第一葉と平行に形成されることは無いので、鱗片葉は第二葉と相同ではない。鱗片葉が他の植物のどのような器官と相同なのか、どのような発生機構によって生じ、進化したのかはわかっていない(Pham and Sinha 2003)。 二枚の葉は1日あたり0.37 mm程度伸長する(Henschel and Seely 2000)ので、年間135 mmくらい葉が伸びることになる。葉の先は徐々に枯れ縦に裂ける。葉の生きた部分が2.5 mにも達する個体もある。葉先が枯れていくので、何年くらい生きているかは不明である。
二枚の葉は1日あたり0.37 mm程度伸長する(Henschel and Seely 2000)ので、年間135 mmくらい葉が伸びることになる。葉の先は徐々に枯れ縦に裂ける。葉の生きた部分が2.5 mにも達する個体もある。葉先が枯れていくので、何年くらい生きているかは不明である。
















 イシモチソウの塊茎(白矢印)は5〜10センチの深さにある。茎が伸びた頃には今年の球茎は黒く枯れている。茎の地下部の鱗片葉の葉腋両側(赤矢印)と鱗片葉の外側(紫矢印)から不定根が出る。なぜこの位置から出るかはわからない。
イシモチソウの塊茎(白矢印)は5〜10センチの深さにある。茎が伸びた頃には今年の球茎は黒く枯れている。茎の地下部の鱗片葉の葉腋両側(赤矢印)と鱗片葉の外側(紫矢印)から不定根が出る。なぜこの位置から出るかはわからない。

 側枝の茎はほとんど伸長せず、小さな鱗片状の葉が形成される(点線)。前図のように、最初、側枝の茎頂は下向きに出るが、途中で向きが反転して、地上側を向く。茎頂部分(矢印)には多数の鱗片葉が形成される。白星印は今年の塊茎の付いていた位置で、周辺に赤みがかった鱗片葉が見える。
側枝の茎はほとんど伸長せず、小さな鱗片状の葉が形成される(点線)。前図のように、最初、側枝の茎頂は下向きに出るが、途中で向きが反転して、地上側を向く。茎頂部分(矢印)には多数の鱗片葉が形成される。白星印は今年の塊茎の付いていた位置で、周辺に赤みがかった鱗片葉が見える。 塊茎を縦割りにすると、維管束(黒点線)がU字型になり、茎頂が途中から上を向いているのがわかる。
塊茎を縦割りにすると、維管束(黒点線)がU字型になり、茎頂が途中から上を向いているのがわかる。 Drosera peltata sensu Vickery 1933では、来年の塊茎以外に、地上シュートの地上部基部や地下部の鱗片葉腋から、ドロッパーdropperと呼ばれる、数センチほど伸長する側枝が形成される(Vickery 1933)。ドロッパーは最初は下方に向かって伸び(左図、赤矢印は茎頂分裂組織、黒線は維管束を示す)、地中をしばらく伸長した後、茎頂が上方に向かって曲がることで側枝(ドロッパー)先端に塊茎ができる(右図)。
Drosera peltata sensu Vickery 1933では、来年の塊茎以外に、地上シュートの地上部基部や地下部の鱗片葉腋から、ドロッパーdropperと呼ばれる、数センチほど伸長する側枝が形成される(Vickery 1933)。ドロッパーは最初は下方に向かって伸び(左図、赤矢印は茎頂分裂組織、黒線は維管束を示す)、地中をしばらく伸長した後、茎頂が上方に向かって曲がることで側枝(ドロッパー)先端に塊茎ができる(右図)。 Drosera lunataでは、地上茎からはドロッパーは形成されないが、地下の鱗片葉から複数のドロッパーが形成され、今年の塊茎の回りに複数の来年の塊茎が形成される。自生地では、何本かがかたまって生えている場合が多いが、これらはドロッパーによる栄養繁殖で増えたと考えられる。
Drosera lunataでは、地上茎からはドロッパーは形成されないが、地下の鱗片葉から複数のドロッパーが形成され、今年の塊茎の回りに複数の来年の塊茎が形成される。自生地では、何本かがかたまって生えている場合が多いが、これらはドロッパーによる栄養繁殖で増えたと考えられる。 オーストラリアに分布する塊茎を持ち地上茎が伸長する種群では、地上茎基部の葉が葉身を形成するか、形成せずに鱗片状になるかが、種を区別する重要な形質となっている。一方、D. lunataでは、基部に葉間の短いロゼット葉を数枚形成する個体と、葉身の無い鱗片状の葉を数枚形成する個体が混在している。どうしてこのような違いが生じるのかはわかっていない。
オーストラリアに分布する塊茎を持ち地上茎が伸長する種群では、地上茎基部の葉が葉身を形成するか、形成せずに鱗片状になるかが、種を区別する重要な形質となっている。一方、D. lunataでは、基部に葉間の短いロゼット葉を数枚形成する個体と、葉身の無い鱗片状の葉を数枚形成する個体が混在している。どうしてこのような違いが生じるのかはわかっていない。








































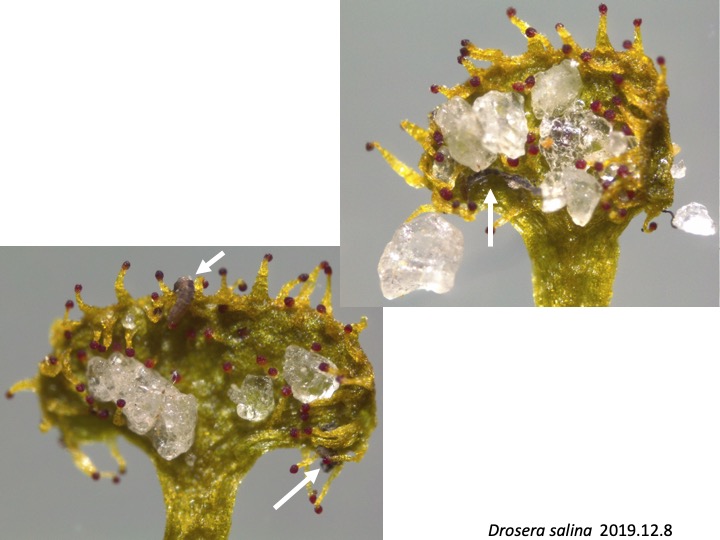
 Drosera salina is locally distributed at the margins of salt lakes but with fresh-water and white sands in Western South Australia (Lowrie 2013).
Drosera salina is locally distributed at the margins of salt lakes but with fresh-water and white sands in Western South Australia (Lowrie 2013).
 Similar underground traps are formed in Philcoxia, which also grows in white sands in Brazil. The history of the discovery is described in Taylor et al.(2000). Fritsch et al. (2007) found trapped nematodes on the leaves and the carnivory was proved by Pereira et al. (2012) by examining absorption of nitrogen compounds from radiolabelled nematodes.
Similar underground traps are formed in Philcoxia, which also grows in white sands in Brazil. The history of the discovery is described in Taylor et al.(2000). Fritsch et al. (2007) found trapped nematodes on the leaves and the carnivory was proved by Pereira et al. (2012) by examining absorption of nitrogen compounds from radiolabelled nematodes.