領域代表のご挨拶
 新学術領域研究「動的クロマチン構造と機能(2013-2017)」が発足いたしました。本領域の略称「クロマチン動構造」は造語です。クロマチンは、動くことによって機能しているのですが、その事実から、“クロマチンの構造変動(動構造)”こそが、その機能発現の本質であると考えました。
新学術領域研究「動的クロマチン構造と機能(2013-2017)」が発足いたしました。本領域の略称「クロマチン動構造」は造語です。クロマチンは、動くことによって機能しているのですが、その事実から、“クロマチンの構造変動(動構造)”こそが、その機能発現の本質であると考えました。
構造生物学的な手法は、歴史的に「形を見る」ことに大きな力を発揮してきました。しかし「動きを見る」ことはあまり得意ではありませんでした。一方で、近年の細胞生物学的手法や生細胞イメージング法の劇的な発展により、細胞レベルで生体高分子の動きを見ることが容易に行われるようになりました。本領域において、これらの「形を見る」ことが得意な手法と、「動きを見る」ことが得意な手法を融合し、本領域ならではのエキサイティングな共同研究を数多く展開していきたいと期待します。
そのためには、できる限り多くの研究者に、直接もしくは間接的に本領域研究に参加していただきたいと希望しています。クロマチン研究における新しい手法の提案、新モデル生物、斬新なアイデアなど、お気軽に領域研究者にお声掛けいただけますようお願い申し上げます。
胡桃坂 仁志(早稲田大学 理工学術院・教授)
計画研究の研究概要
公募研究の研究概要 (H28-H29年度)
公募研究の研究概要 (H26-H27年度)
計画研究
 「再構成ヌクレオソームを用いた動的クロマチン構造の解明」
「再構成ヌクレオソームを用いた動的クロマチン構造の解明」代表者:胡桃坂 仁志 分担者:堀 哲也
ヌクレオソームは、クロマチンの基盤構造であり、そのタンパク質構成成分であるヒストンには種々のバリアントが存在する。さらにヒストンは様々な化学修飾を受けている。また、クロマチンは、リンカーヒストンとヌクレオソームが凝集した状態で、動的に構造を変えながら機能発現をしている。本研究では、精製したヒストンバリアント、変異体、修飾体、リンカーヒストンなどを用いて、機能的なヌクレオソーム、クロマトソーム、およびクロマチンを再構成し、それらの高次構造および動的変動を構造生物学的および計算科学的手法により解析する。並行して、生化学的、遺伝学的、細胞生物学的、およびオミクス解析を行い、種々のクロマチンの機能解析を行う。これらの解析を通して、真核生物の動的クロマチン構造と機能の解明に挑む。
 「シミュレーション計算による動的クロマチンのダイナミクス解析」
「シミュレーション計算による動的クロマチンのダイナミクス解析」代表者:河野 秀俊
ヒトなど真核生物のゲノムDNAはクロマチン構造の形で核内にコンパクトに収納されている。クロマチン構造は、ヒストンタンパク質8量体にDNAが約150塩基対巻きついたヌクレオソームを基本構造とし、その形をダイナミックに変えながら遺伝子の発現制御を行っている。本研究では、次々と存在が明らかにされているヒストンバリアントやヒストン及びDNAの化学修飾が、ヌクレオソームやクロマチンの動構造に与えるインパクトを計算機シミュレーションによって調べ、クロマチン動構造と遺伝子発現制御の関係を明らかにすることを目指す。
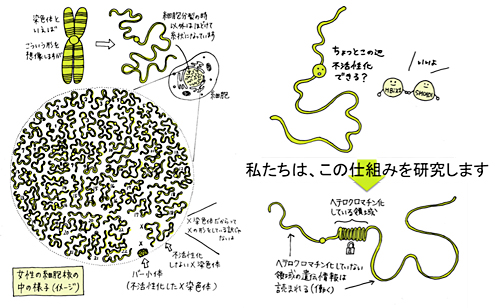
 「ヘテロクロマチンの構造と機能の理解」
「ヘテロクロマチンの構造と機能の理解」代表者:小布施 力史
様々な生命現象は、約2万種類の遺伝情報を、どのタイミングで、どのくらい読み取るかを緻密に制御し、タンパク質の働きをコントロールすることにより成り立っている。この制御がうまくいかないと、様々な疾患を引き起こしてしまう。遺伝情報は46本の染色体に格納されている。染色体はあちこちで小さく折りたたまれて凝縮していることが知られている。染色体が小さく折りたまれて凝縮(ヘテロクロマチン化)することは遺伝情報の読み取りの制御方法のひとつで、一言でいえば<読み取り不要な部分をロックする仕組み>である。この仕組みは、遺伝情報のコントロールに非常に大切であることがわかっている。この研究班では、如何に染色体が小さく折りたたまれ、如何に遺伝情報の読み取りを制御しているのかについて、明らかにしていく。
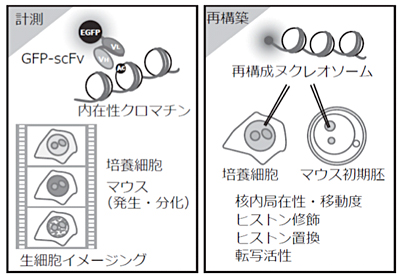
 「計測と再構築による生細胞内クロマチンダイナミクスの高次元的理解」
「計測と再構築による生細胞内クロマチンダイナミクスの高次元的理解」代表者:木村 宏 分担者:山縣 一夫
種々の生命現象におけるクロマチン構造の制御と意義を理解するためには、生細胞内のクロマチンダイナミクスをさまざまな時間軸で高次元的に捉える必要がある。本研究では、生細胞・生体内エピゲノム修飾可視化技術の開発を通じて、特定のヒストン修飾を持つクロマチンの動態の「計測」と再構成ポリヌクレオソームを用いた「再構築」を行うことで、生細胞・生体内におけるクロマチンの動的変化とその意義を明らかにする。また、再構成ヌクレオソームを培養細胞や受精卵の核に導入し、ヒストンバリアントやヒストン修飾のクロマチン動態と機能制御における意義を明らかにする。本研究による成果は、クロマチン関連基礎研究にとどまらず、再生医療、生殖医療、薬剤開発等にも広く波及効果が期待できる。
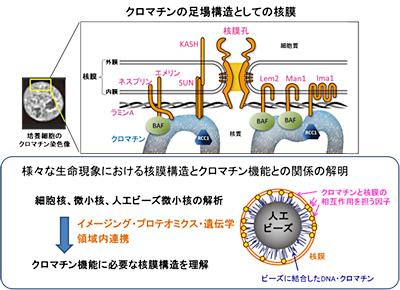
 「クロマチン機能を保証する核膜の構造と分子基盤」
「クロマチン機能を保証する核膜の構造と分子基盤」代表者:原口 徳子 分担者:淺川 東彦
クロマチンが正常に機能するためには、その足場となる核膜が正常に維持されなければならない。本研究は、様々な生命現象(細胞増殖、発生、分化、老化、減数分裂など)における核膜構造とクロマチン機能との関係を、独自に開発したイメージング法や、プロテオミクス、遺伝学などの手法を用いて分子レベルで解明するものである。具体的には、人工ビーズ周辺に形成される人工微小核やガン細胞でみられる微小核の核膜構造を解析することによって、クロマチン機能と核膜構造との連関を解析する。進化的に保存されている核膜タンパク質に関しては、遺伝学的な手法に優れた分裂酵母を用いて、そのクロマチン機能への影響を検討する。これらの解析から、クロマチン機能を保証する核膜の構造と分子基盤を明らかにする。
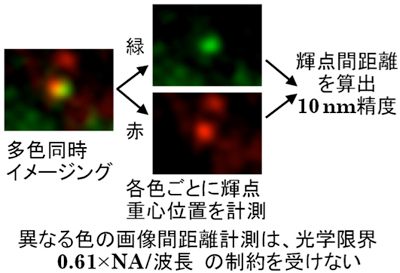
 「1分子in vivoイメージング超解像ナノ解析によるクロマチン動作原理解明」
「1分子in vivoイメージング超解像ナノ解析によるクロマチン動作原理解明」代表者:徳永 万喜洋
動的クロマチン構造の解明を目的として、生細胞多色1分子イメージング超解像ナノ解析法の開拓により、クロマチン構造の細胞レベルin vivo 分子動態・要素間相互作用・核内配置のダイナミズムを解明する。
これまでに開発してきたリアルタイム1分子イメージング技術開発の成果を生かし、多色超解像顕微鏡法、in vivo1分子FRET、定量ナノ解析(動態・濃度・時空間局在・相互作用の定量)を開拓する。これにより、再構成クロマチン動態・原子座標動構造解析、新規同定構成要素の動態、ヒストン修飾状態と転写制御、クロマチンリモデリング複合体動態、染色体・分子操作技術に関する共同研究を、密接な相補的融合研究として領域内展開する。当分野にイノベーションをもたらし、機能的クロマチンの複合体ダイナミクスと動構造の新しい姿を明らかにする。
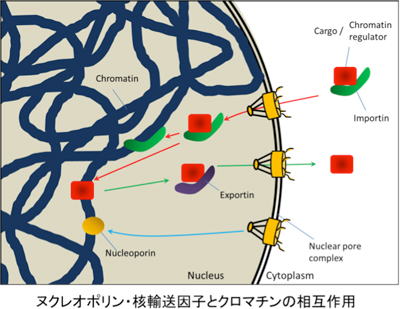
 「核膜孔複合体構成因子・核輸送因子によるクロマチン動態制御の解明」
「核膜孔複合体構成因子・核輸送因子によるクロマチン動態制御の解明」代表者:米田 悦啓 分担者:岡 正啓、安原 徳子
動的クロマチン構造の制御はさまざまな高次生命機能に重要であり、その制御異常は多くの疾患と関連している。最近、真核生物の核と細胞質間の分子輸送を担う核膜孔構成因子(ヌクレオポリン)や輸送因子(Importin)が、核内でクロマチンと機能的な相互作用を示すことが明らかになってきた。また、クロマチンが存在する核に適切なタイミングで分子を出し入れすることはクロマチンの構造の制御に必要であると考えられる。本研究では、ヌクレオポリン・核輸送因子とクロマチンの物理的・機能的な相互作用の解析を行い、その実体を明らかにする。さらに、その機能破綻と病態の関連に着目し、ヌクレオポリン・核輸送因子による動的クロマチン構造制御の重要性を明らかにする。
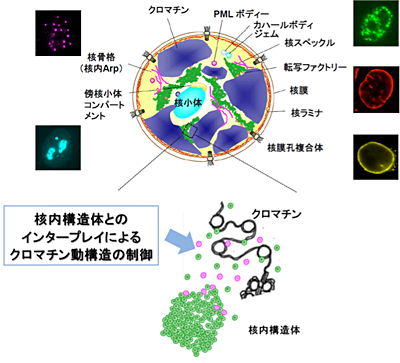
 「核内構造体とのインタープレイによるクロマチン動構造の制御」
「核内構造体とのインタープレイによるクロマチン動構造の制御」代表者:斉藤 典子 分担者:原田 昌彦
クロマチンは、核小体、核スペックル、核骨格などの核内構造体と共に核内空間に秩序正しく収納され、これらの核内構造体との相互作用によりクロマチン機能や動態が制御されている。本研究では、このような高次構造レベルでのクロマチン制御に関わる因子を、核-クロマチンインターフェース因子(I/F因子)と位置づけ、新規I/F因子の網羅的検索・同定、I/F因子のクロマチン制御における分子機能の解析を行う。I/F因子を軸として、核内の高次構造に基づいた新たなクロマチン制御メカニズムを明らかにすることに挑戦する。並行して、ハイスループット顕微鏡やパターン認識法を駆使したイメージング解析を行い、セルベースドアッセイスクリーニング法などの確立に貢献する。
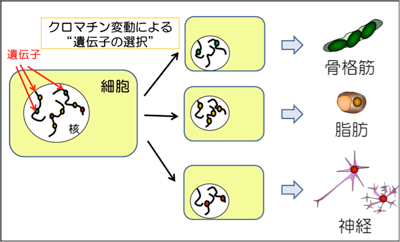
 「細胞分化にともなうクロマチン変動メカニズムの解明」
「細胞分化にともなうクロマチン変動メカニズムの解明」代表者:大川 恭行
細胞分化の過程では、ゲノム上に存在する2-3万もの遺伝子から特定遺伝子の発現が選択され、それぞれが異なる形質を獲得する。この選択的な遺伝子発現には“動的クロマチン構造”が機能しており、その理解のためには、ヒストンバリアントの選択、ヒストン修飾から、クロマチン高次構造に至る幅広いクロマチン変動メカニズムを全ゲノムレベルで明らかにする必要がある。本研究では、主に骨格筋分化をモデルとし、次世代シークエンサーを用いたゲノムワイドな解析(ヒストン修飾、クロマチン構造、遺伝子発現)により、クロマチン変動による遺伝子発現の選択機序の解明を目指す。
公募研究 (H28-H29年度)
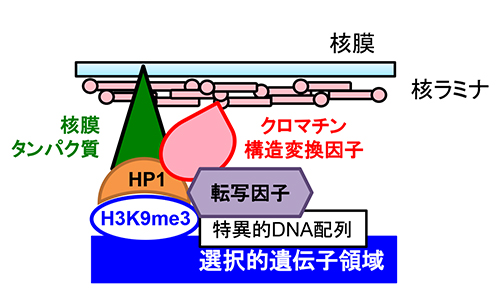
 「選択的遺伝子領域の動的ヘテロクロマチン化誘導機構」
「選択的遺伝子領域の動的ヘテロクロマチン化誘導機構」代表者:落合 恭子
転写因子は特異的DNA配列認識能を保有し、種々のエピゲノム制御因子との複合体形成によって標的遺伝子発現を制御する。クロマチン凝集形態であるヘテロクロマチンは特異的遺伝子領域の核膜トラッピングを介して遺伝子抑制に寄与するが、ヘテロクロマチン化領域の決定には選択性が存在する。転写因子複合体にクロマチン構造変換因子および核膜タンパク質が含まれることを考慮すると、転写因子機能を始点とした選択的遺伝子領域ヘテロクロマチン化機構の存在が示唆される。本研究では、細胞分化過程で生ずる誘導的ヘテロクロマチン化領域における経時的な核内ポジショニングを追跡し、選択的遺伝子領域の三次元的クロマチン構造変換機構の理解を目指す。
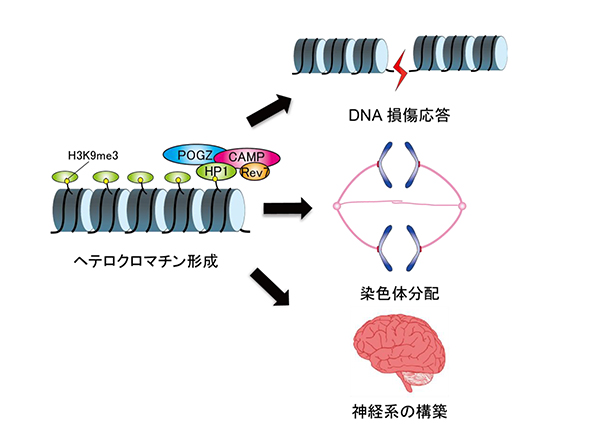
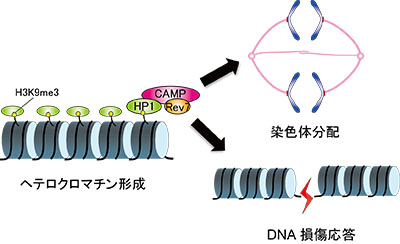
 「新規分子CAMPを含むへテロクロマチン結合複合体によるゲノム安定性維持機構」
「新規分子CAMPを含むへテロクロマチン結合複合体によるゲノム安定性維持機構」代表者:田中 耕三
ヘテロクロマチン形成によるクロマチン構造の動的な制御には、HP1(heterochromatin protein 1)を含むヘテロクロマチン結合複合体が重要な役割を果たしている。応募者らが同定した新規分子CAMPは、HP1およびDNA損傷応答に関連するRev7、染色体分配に関与するPOGZと共にヘテロクロマチンと結合する主要な複合体を形成していると考えられるが、そのはたらきについては不明な点が多い。最近小児の知的発達障害においてCAMPとPOGZの変異が見られることが明らかになった。本研究では、DNA損傷応答・染色体分配・神経系の構築など様々な機能をもつCAMPを含む複合体が、クロマチン構造変化を通じてどのようにゲノム安定性を維持しているのかを、構造生物学的解析にもとづいて細胞及び個体レベルで明らかにする。
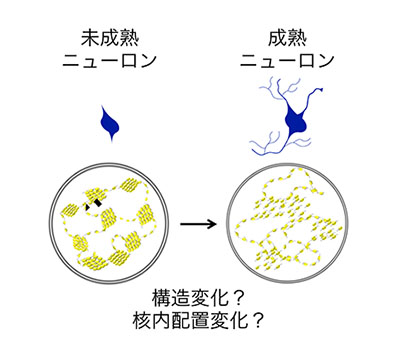
 「クロマチン構造変化の可視化によるニューロン分化遺伝子群制御機構の解明」
「クロマチン構造変化の可視化によるニューロン分化遺伝子群制御機構の解明」代表者:岸 雄介
ニューロンは我々の思考や行動を司る非常に重要な細胞であり、発生過程でニューロンがどのように形成されるかを知ることは、我々の脳の成り立ちを理解するだけでなく、脳の発生異常による多くの精神疾患を理解するためにも重要である。ニューロンは、神経突起やシナプスなどの特徴的な形質を獲得する分化過程において、数千もの遺伝子の発現が一斉に変化することが知られている。しかしながらこれらの非常に多くのニューロン関連遺伝子群がどのようにして協調的に発現制御されているかは未だ不明である。本研究では、クロマチンの構造変化や核内配置の変化がニューロン分化過程における協調的な遺伝子発現変化のメカニズムとして機能しているという仮説を検証し、細胞分化のクロマチン動態変化における新しい概念を確立することを目指す。
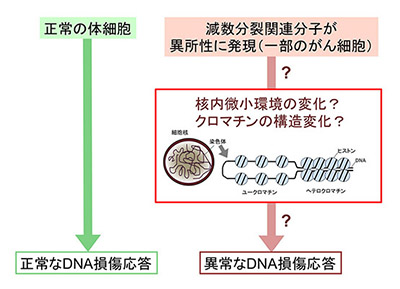
 「DNA修復とクロマチン制御の統合的理解によるがん治療への応用」
「DNA修復とクロマチン制御の統合的理解によるがん治療への応用」代表者:細谷 紀子
DNA修復は、遺伝情報を安定に維持するために不可欠なシステムであり、その異常は、がんの発症につながるとともに、がん治療への反応性にも変化をもたらす。近年、DNA蛋白質複合体であるクロマチンの構造変換がDNA損傷に対する生体の応答の制御において重要な役割を果たすことが示唆されているが、その詳細な分子メカニズムについては不明の点が多い。我々は最近、正常細胞では殆ど発現せず、一部のがんにおいて発現が上昇することが知られる減数分裂関連分子群の一部が、体細胞のDNA修復に多様な影響を与え得ることを見い出している。本研究では、これらの減数分裂関連分子が体細胞でのクロマチン制御に果たす役割を明らかにし、がんにおけるDNA修復とクロマチン制御の分子ネットワークを統合的に理解することにより、新しいがん治療の開発のための分子基盤を構築することを目指す。
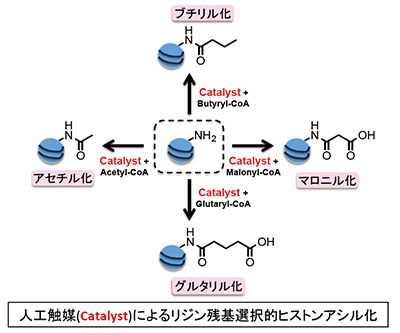
 「人工触媒システムを用いたヒストンアシル化の機能解析」
「人工触媒システムを用いたヒストンアシル化の機能解析」代表者:川島 茂裕
研究紹介:ヒストンは、クロマチンを構成する主要なタンパク質であり、様々な翻訳後修飾をうけることにより、多様なヌクレオソーム構造とそれに伴う遺伝子転写等の動的制御を可能にしている。近年の質量分析技術の発展により、ヒストンはこれまで想像していた以上に複雑な翻訳後修飾を受けていることが明らかになり、特にヒストンに数多く含まれるリジン残基には、これまで最も研究されてきたアセチル化だけではなく、ブチリル化やマロニル化等の様々な種類のアシル化修飾が同定された。本研究では、独自に開発した新規人工触媒システムを用いてクロマチンに特定のリジン残基選択的アシル化を導入することにより、機能未知のヒストンアシル化の動的クロマチン制御における機能を明らかにすることを目的とする。
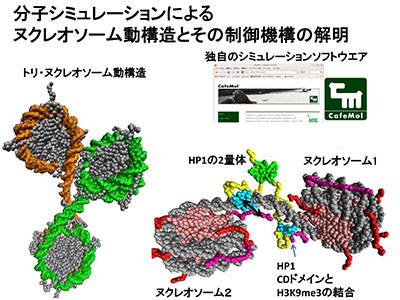
 「ヌクレオソーム動構造とそのエピジェネティック制御の分子シミュレーション研究」
「ヌクレオソーム動構造とそのエピジェネティック制御の分子シミュレーション研究」代表者:高田 彰二
ヌクレオソーム・クロマチンは、静的な構造物ではなく、細胞状況に応じて変化する柔らかな動構造を示す。例えば、ヌクレオソームはリモデラー等の作用によりスライディングし、ゲノム上で結合位置を変える。これらの柔らかな動構造は、構造生物学等の実験手法のみにより明らかにすることが困難であり、相補的な意味で分子シミュレーションによる貢献が重要である。本研究では、独自の粗視化分子シミュレーション技法によって、ヌクレオソームの柔らかな動構造および、制御因子によるその動構造の認識・改変の分子機構を明らかにすることを目指す。特に、ヘテロクロマチン蛋白質HP1 によるメチル化ヒストン認識の動構造解析、Polycomb 群PRC2 によるメチル化状態維持の動構造解析、ヌクレオソームスライディングの構造転移解析、ヌクレオソームからのヒストン放出の動構造解析などを行う。
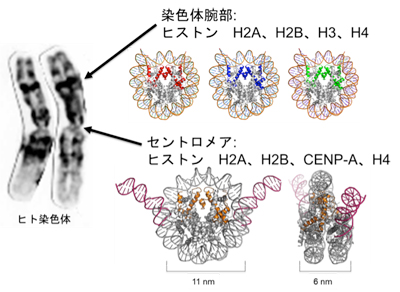
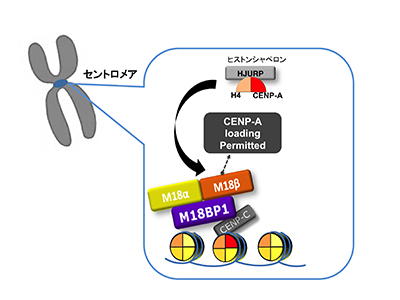
 「セントロメアにおけるクロマチン構造制御の分子基盤」
「セントロメアにおけるクロマチン構造制御の分子基盤」代表者:有吉 眞理子
遺伝子をコードしていない反復配列DNAと様々なタンパク質因子で構築されるセントロメアは、細胞周期におけるダイナミックなクロマチン動態と正常な染色体分配を制御するクロマチン構造である。セントロメア形成の核となるのは、セントロメア特異的なヒストンH3 バリアントであるCENP-Aである。特徴的なCENP-Aヌクレオソーム構造を目印として、様々なセントロメアタンパク質が会合し、機能的なセントロメアが構築される。したがって、複製後のセントロメア領域へのCENP-Aの取り込みは、細胞周期と同調して厳密に制御されている。本研究では、CENP-Aのセントロメア領域への取り込みを制御するライセシング因子であるMis18複合体の構造機能解析を行い、機能的なセントロメア形成の時間・空間的制御の実体を明らかにする。
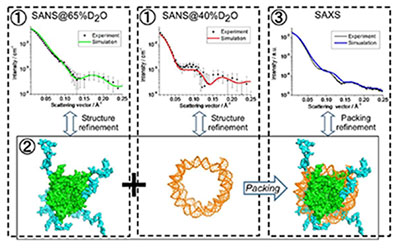
 「量子ビーム散乱法の協奏的利用による機能性ヌクレオソームの溶液構造解析」
「量子ビーム散乱法の協奏的利用による機能性ヌクレオソームの溶液構造解析」代表者:杉山 正明
クロマチンの基本構成単位であるDNAとタンパク質(ヒストン)の複合体ヌクレオソームは非常に安定な構造体であり、遺伝子の貯蔵庫としての機能を担っている。一方、転写などの機能活性時はこの安定状態からはずれた構造になる必要がある。この状態のヌクレオソームは構造不安定であることもあり結晶化が困難である。そこで、本研究は溶液中でのこの機能活性状態のヌクレオソームの構造をX線・中性子を用いた溶液散乱法で測定し、従来の方法に加えMDなどの計算機シミュレーションを用いた解析により明らかにすること目指します。X線散乱(SAXS)はヌクレオソームの全体構造の測定に有効であり、中性子散乱(SANS)はDNAとタンパク質の散乱能違いと溶媒の軽水/重水混合比の制御による溶媒の散乱能の可変性を利用した測定法により、DNAとタンパク質のどちらかを選択的に観測することが可能とします。
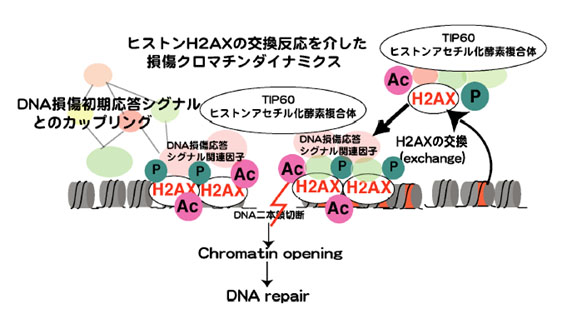
 「ヒストンH2AXの交換反応を介した損傷クロマチンダイナミクス」
「ヒストンH2AXの交換反応を介した損傷クロマチンダイナミクス」代表者:井倉 毅
我々は、TIP60ヒストンアセチル化酵素複合体によってアセチル化されたヒストンH2AXが、損傷領域に取り込まれ、そのことが、ゲノム損傷領域のクロマチンの弛緩とDNA損傷応答関連因子の集積を促すことを見出した。本課題では、TIP60およびH2AX複合体精製による生化学的解析とそれら構成因子のバイオイメージング解析を組み合わせながら、H2AXの動的な変化を介したゲノム損傷領域のクロマチン構造変換機構の解明を行う。さらに損傷クロマチンの構造変換が、ゲノム損傷応答シグナルや核内構造と如何なる連携を取りながら、ゲノム修復を制御しているのかについても検討を加え、クロマチンの動的変化に伴うゲノム損傷ストレス応答の統合的な理解を目指したい。
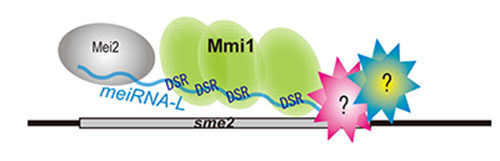
 「染色体上の非コードRNAが動的クロマチン構造を制御する仕組み」
「染色体上の非コードRNAが動的クロマチン構造を制御する仕組み」代表者:平岡 泰
相同染色体の対合・組換えは、正常な減数分裂に必須であり、その理解は生殖を行うすべての真核生物に共通に重要である。分裂酵母では、減数分裂期に特定の遺伝子から転写され、その遺伝子座に蓄積する非コードRNAが、相同染色体の対合に必須であることがわかっている。しかし、このような非コードRNAが相同染色体の対合を促進する仕組みは分かっていない。本研究では、分裂酵母を用いて、減数分裂特異的に転写される非コードRNA(meiRNA)が染色体上の sme2遺伝子座に蓄積する仕組みを研究し、クロマチン動構造と RNAの相互作用を理解することを目指す。ほ乳類X染色体の不活性化においても、X染色体から転写される非コードRNAがX染色体に蓄積することが、不活性化に重要な働きをする。分子遺伝学的解析と分子イメージングが容易な分裂酵母をモデル生物として用いて解析することにより、真核生物に普遍的な仕組みの解明を目指す。
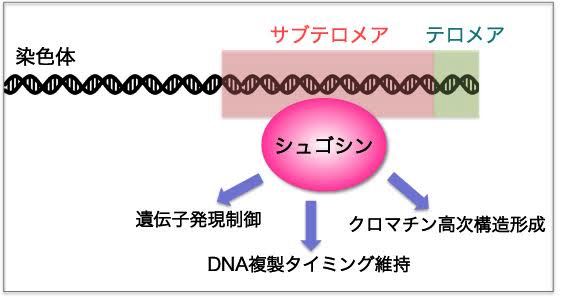
 「サブテロメアクロマチン構造の動的制御メカニズム」
「サブテロメアクロマチン構造の動的制御メカニズム」代表者:加納 純子
真核生物の線状染色体の末端にはテロメアと呼ばれる構造体が存在し、染色体構造維持、生殖細胞の半永久的維持、細胞寿命制御、減数分裂期の進行などにおいて重要な役割を果たしている。一方、テロメアに隣接する染色体領域であるサブテロメアについては、実験手法的困難から機能の解明があまり進んでいない。最近我々は、細胞分裂期にセントロメアに局在するSgo2タンパク質が間期にサブテロメアにリクルートされ、サブテロメア領域の高次クロマチン構造形成、サブテロメア遺伝子群の発現制御、サブテロメアのDNA複製タイミング制御において重要な役割を果たすことを明らかにした(Tashiro et al., 2016)。本研究では、最近我々が作製したサブテロメア完全欠失株の解析やサブテロメア遺伝子群発現異常株の単離などを通じて、サブテロメアに形成される高次クロマチン構造の時期特異的な制御メカニズムや機能を明らかにする。
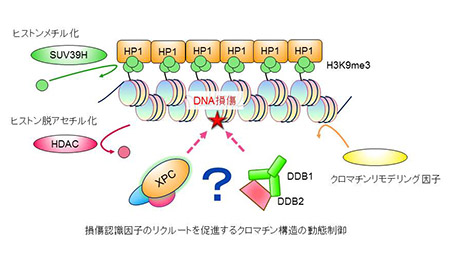
 「クロマチン動構造を介したDNA損傷修復制御の分子基盤」
「クロマチン動構造を介したDNA損傷修復制御の分子基盤」代表者:菅澤 薫
DNA損傷は長大なゲノムの何処で何時発生するか生物にとって予測することは困難であり、その修復においてはプログラムされた遺伝子発現等とは異なるクロマチン構造を介した制御機構が関与している可能性が考えられる。特に損傷認識因子と呼ばれるタンパク質と損傷部位との相互作用が修復反応全体の効率を左右する鍵を握っているが、この過程を制御するクロマチン構造側の動態については不明な点が多く残されている。 本研究では、ヌクレオチド除去修復機構においてDNA損傷認識を担うC群色素性乾皮症(XPC)タンパク質の核内局在制御に焦点をあて、損傷認識と修復開始を制御するヒストン修飾やヘテロクロマチン構成因子の役割を解明する。ゲノム安定維持に関わるクロマチン動構造の新たな側面を明らかにするとともに、DNA修復の促進を介した疾患の制御にもつながる新たな分子機構の理解を目指す。
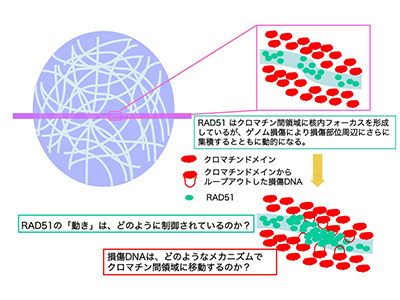
 「ゲノム修復における動的クロマチン構造変換」
「ゲノム修復における動的クロマチン構造変換」代表者:田代 聡
染色体や核内蛋白質が構築する細胞核高次構造はクロマチン構造を反映し、DNA代謝の制御に重要な役割を果たしていると考えられています。代表的な細胞核構造のモデルである染色体領域-クロマチン間領域モデルによれば、染色体領域は数Mbの染色体DNAを含むクロマチンドメインと、クロマチンドメインの間隙で様々な機能的蛋白質が存在するクロマチン間領域から構築され、転写やスプライシングは、クロマチンドメインの表面で行われる可能性が示されています。しかし、ゲノム修復と細胞核高次構造の関連については未だ不明です。我々は、最も重篤なゲノム損傷であるDNA二本鎖切断の主な修復機構のひとつである相同組換え修復(HR)で重要な役割を果たす蛋白質RAD51が、過剰発現によりクロマチン間領域内の束状の領域に集積されること、この領域内に損傷DNA が存在することを見いだし、この領域はHRが行われる場所である可能性が示唆されました。そこで本研究では、この領域でのRAD51動態の制御機構と、損傷DNAのこの領域への移動の制御機構について検討することで、ゲノム修復における動的クロマチン構造変換の役割の解明に取り組みたいと考えています。
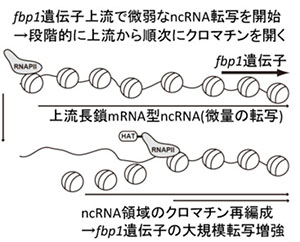
 「非コードRNAによるクロマチン・高次ゲノム構造制御機構の解明」
「非コードRNAによるクロマチン・高次ゲノム構造制御機構の解明」代表者:廣田 耕志
昨今の網羅的転写研究から、ゲノムの大半を占める非コード領域で転写が起こっていることが明らかになった。このような非コードRNA分子転写の意義は議論の的となっている。私たちの研究グループでは、非コードRNA転写にそって、転写領域のクロマチンが開いた構造へと変化する現象を発見し、一般的な非コードRNA転写の意義の一部を解明した。このような、非コードRNA転写と共役したクロマチンの制御は、転写や組換えと言ったDNAに酵素が相互作用する反応に先立ってみられる。非コードRNA転写と共役したクロマチン制御の素過程の理解や、転写因子や抑制因子などによる制御機構との関わりについて解明を行う。
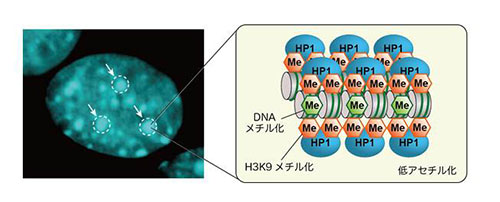
 「HP1による動的クロマチン構造変換の制御」
「HP1による動的クロマチン構造変換の制御」代表者:中山 潤一
真核細胞の核内には高度に凝縮した「ヘテロクロマチン」と呼ばれる構造が存在している。細胞はヘテロクロマチン構造によってトランスポゾンなどの転移因子の発現を抑え、反復配列の増幅を抑制している。さらに、個体の発生や細胞の分化に伴うエピジェネティックな遺伝子発現や、セントロメアやテロメアなどの染色体ドメインの構築にも必須な役割を果たしている。これまでの研究から、ヘテロクロマチンの構造形成には特徴的なヒストンのメチル化修飾と、その修飾を認識して結合するヘテロクロマチンタンパク質HP1が重要な役割を果たしていることが明らかにされている。しかし、HP1がどのようにヌクレオソームに結合し、クロマチンの動的な構造変換を促進しているのか、その詳細なメカニズムには不明な点が多く残されている。本研究では、HP1の生化学的な解析を通じて、ヘテロクロマチン構造形成の分子機構を明らかにすることを目指す。
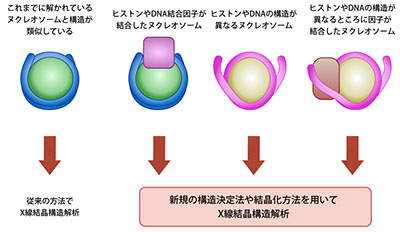
 「ヌクレオソームの多様な構造を解析する技術の開発」
「ヌクレオソームの多様な構造を解析する技術の開発」代表者:香川 亘
クロマチンはダイナミックに構造変化することによって、生命活動の維持に必要なDNA複製、転写、修復と組換えを可能にする。クロマチン構造変化の分子機構を理解するためには、クロマチンの基本単位であるヌクレオソームにおける構造変化を、原子レベルで明らかにすることが重要である。ヌクレオソームは、それを構成するヒストンとDNA、そして結合因子によって多様な構造を形成することが近年明らかになりつつある。本研究では、多様なヌクレオソーム構造やヌクレオソームとその結合因子との複合体の構造解析を、X線結晶構造解析法を用いて行うための新たな結晶化方法や解析方法の開発を行う。
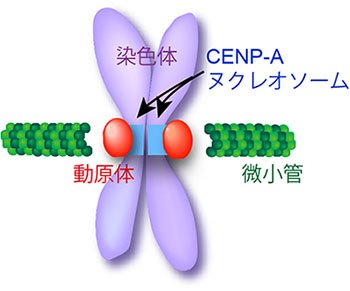
 「分裂酵母CENP-Aヌクレオソームと動原体の再構築」
「分裂酵母CENP-Aヌクレオソームと動原体の再構築」代表者:佐藤 政充
1個の細胞が2個に分裂するとき、我々の遺伝情報を含む染色体DNAは2個の細胞に均等に分配される。正確に分配されないと細胞死・がん化・ダウン症候群など先天性トリソミーの原因となりうる。したがって染色体は必ず均等に1:1に分配されなければならない。その鍵は、各染色体DNAに1箇所だけ存在する「セントロメア」領域である。セントロメアDNAには通常のヒストンH3タンパク質のかわりにCENP-Aと呼ばれる独特のヒストンH3が入り込み、これを足場として多数のタンパク質が呼び込まれて「動原体」を形成する。動原体は紡錘体微小管に捉えられることによって、染色体が1:1に分配されることを保証している。ここで私たちは原点に立ち返り、なぜセントロメアにCENP-Aが呼び込まれるのかという疑問に興味を持った。我々が単離した分裂酵母のkis1変異体ではCENP-Aの呼び込みに欠陥があった。これを足掛かりとして、この生物学上の大きな問いに答えたいと考えている。
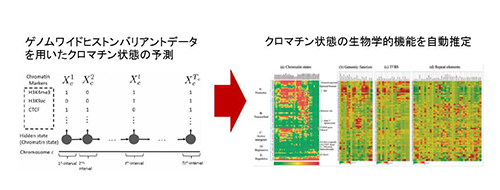
 「ヒストンバリアントに基づくクロマチンの機能の推定」
「ヒストンバリアントに基づくクロマチンの機能の推定」代表者:浜田 道昭
ヒストンの修飾およびヒストンバリアントはクロマチンの機能に重要な役割を果たしている。申請者は 2015年に、ゲノムワイドなエピゲノムデータからクロマチン状態を推定するための情報技術の開発し、ゲノムワイドなヒストン修飾のデータに対して適用を行った。一方で、申請者が開発した方法では、各クロマチン状態がどのような生物学的な意味・意義を持っているかを自動的に予測することはできない。また、上述のクロマチン状態のゲノムワイドな推定では、ヒストン修飾データを主にに利用し、ヒストンバリアントのデータは用いていなかった。世界的に見ても、ヒストンバリアントのデータを大規模に用いたクロマチン機能の推定は行われていない。このような背景を受け、本研究では、ヒストンバリアントがクロマチンの機能にどのような影響を与えるかを情報技術を用いて明らかにする。
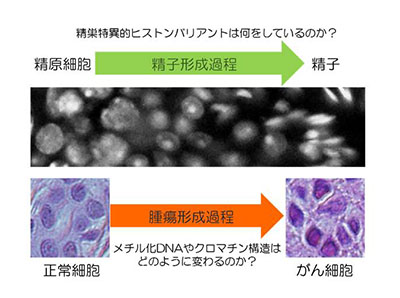
 「雄性不妊及び発がん過程のクロマチン動態解析」
「雄性不妊及び発がん過程のクロマチン動態解析」代表者:上田 潤
近年の研究からエピジェネティクス及びクロマチン構造は発生・分化過程のみならず、がん化などの病態進行過程においてもダイナミックに変化することが明らかとなってきている。本研究では「病態進行過程におけるクロマチン構造の動態変化」をキーワードに、二つのテーマを推進する。一つ目のテーマでは、マウスの精巣特異的ヒストンH3バリアントであるH3tに着目し、クロマチン構造が大規模に変動する精子形成過程においてH3tがどのような役割を担っているのかを明らかにする。二つ目のテーマでは、メチル化DNAを可視化したレポーターマウス「メチロー」を用いて、腫瘍形成過程にメチル化DNA及びヘテロクロマチン構造がどのように変動するかを解析する。
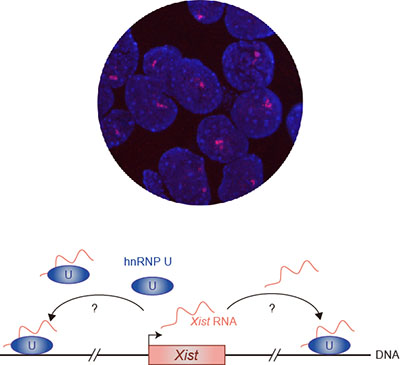
 「ヘテロクロマチン形成とクロマチン環境」
「ヘテロクロマチン形成とクロマチン環境」代表者:佐渡 敬
エピジェネティック制御因子と相互作用する一部の長鎖ノンコーディング(lncRNA)は、特定のゲノム領域を標的とし、その領域のクロマチン修飾の確立に重要な役割果たす。そうしたlncRNAのクロマチンターゲティング機構は、エピジェネティクスを理解する上で重要な課題の一つといえるが、まだまだ不明な点が多い。哺乳類のメスでは、胚発生初期に2本あるX染色体のうち一方からだけ転写されるXistと呼ばれるlncRNAが、このX染色体全体を覆い、染色体ワイドのヘテロクロマチン化を引き起こす。本研究では、このXist RNAの局在制御に関与することが培養細胞で示されたhnRNP Uに着目し、lncRNAのクロマチンターゲティングにおける機能と役割について解析を行う。
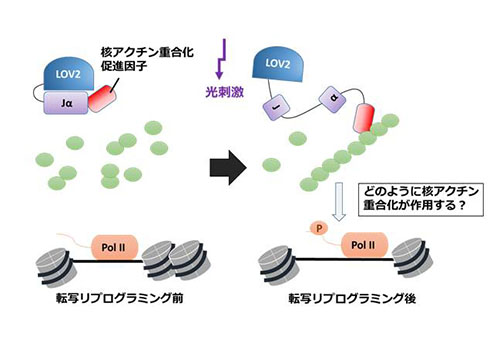
 「時空間的核アクチン重合化制御によるクロマチン構造と転写状態の変動」
「時空間的核アクチン重合化制御によるクロマチン構造と転写状態の変動」代表者:宮本 圭
研究紹介: 体細胞核を卵母細胞内に移植することにより、発現抑制された遺伝子が活性化する転写リプログラミングという現象が起こる。我々は核内に存在するアクチン(核アクチン)が転写リプログラミングに重要であることを示した。核アクチンは核内構造の変化、クロマチンリモデリング、さらにはRNAポリメラーゼによる転写に直接関与するとの報告があるが、転写リプログラミングにおける詳細な働きは明らかになっていない。そこで本研究では、オプトジェネティックスの手法を利用して、リプログラミングの特定の時期に、また特定の遺伝子座で核アクチンの重合化を制御し、核アクチン重合化がクロマチン構造の変化および転写活性化状態の変動に及ぼす影響を明らかにする。
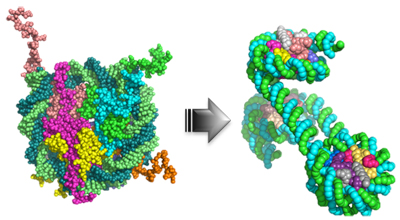
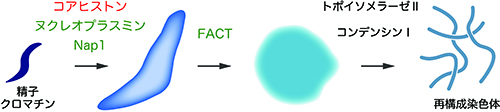
 「ヒストンを基盤とした染色体構築メカニズムの解明」
「ヒストンを基盤とした染色体構築メカニズムの解明」代表者:新冨 圭史
染色体構築は細胞分裂に伴う正確な遺伝情報の継承に不可欠なプロセスである。しかし、染色体の基本構造単位であるヌクレオソーム、もしくは、その構成成分であるコアヒストンが染色体構築にどのような貢献しているのかは不明な点が多い。最近、私たちはわずか6種類のタンパク質を使って、染色体を再構成できることを報告した(図)。また、カエル卵抽出液の無細胞系を改変し、ヌクレオソームを含まない染色体様構造を作ることにも成功した。これらの実験系では、ヒストンやヒストンシャペロンに対する精緻な実験操作の結果として特徴的な形状のクロマチンが作られる。本研究では、超解像光学顕微鏡や原子間力顕微鏡を用いて、様々なクロマチンに対して高精細な構造解析を行う。さらに、得られた情報に基づいて、染色体内でヌクレオソーム繊維がどのように折り畳まれているのかという古典的命題にも独自の視点から検討を加えたい。
公募研究(H26-H27年度)
 「へテロクロマチン結合複合体によるゲノム安定性の動的制御」
「へテロクロマチン結合複合体によるゲノム安定性の動的制御」代表者:田中 耕三
ヘテロクロマチン形成はクロマチン動構造制御の重要な一翼を担っており、これに関与するHP1 (heterochromatin protein 1)は遺伝子発現の制御だけでなく、DNA損傷応答や染色体分配にも関与することが知られている。応募者らがDNA損傷応答に関連するRev7と結合する分子として同定したCAMP (C13orf8)は、染色体分配に必須の役割を果たしている(EMBO J 2011)。興味深いことにRev7とCAMPは、HP1と共にヘテロクロマチン領域のマーカーであるトリメチル化されたヒストンH3の9番目のリジンに結合する主要な複合体を形成している。そこで本研究では、クロマチン構造変化とDNA損傷応答、染色体分配の関連について解析し、CAMP, REV7, HP1 からなる複合体がこれらの機能を統合している可能性について検討する。
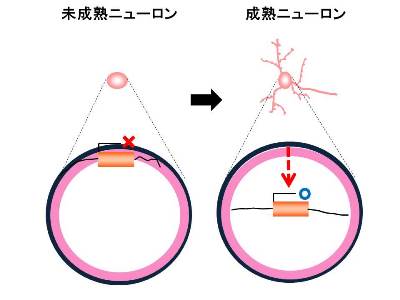
 「ニューロンにおける細胞核構造と遺伝子発現における核ラミナの意義」
「ニューロンにおける細胞核構造と遺伝子発現における核ラミナの意義」代表者:滝沢 琢己
遺伝子の発現制御には、転写因子やエピジェネティクスに加えて、遺伝子座の空間配置も重要であることがわかってきている。一方、ニューロンは、最終分裂を終えた後に劇的に形態や機能を変化させる成熟の過程をたどる。この過程での遺伝子座の空間配置変化とその意義については不明な点が多い。私たちは、マウス海馬ニューロンの成熟過程における核を構成する蛋白質の機能および発現変化が、遺伝子座の核内配置や発現制御に重要な役割を有しているのではないかという仮説を立て、それを検証することで、新規な観点からニューロンの機能を明らかにしたいと考えている。
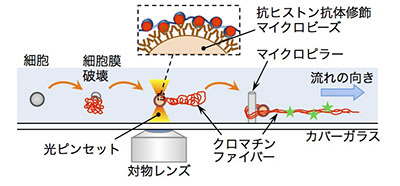
 「マイクロ流体デバイスを用いたゲノムサイズクロマチンの高次構造変化実時間観察」
「マイクロ流体デバイスを用いたゲノムサイズクロマチンの高次構造変化実時間観察」代表者:小穴 英廣
本研究課題においては、微細加工によって作製したマイクロ流体デバイス内、蛍光顕微鏡下において、個々の細胞からクロマチンファイバーを断片化を抑えつつ取り出し、取り出したクロマチンファイバーを光ピンセットと抗ヒストン抗体修飾マイクロビーズを用いた微細操作技術によって伸展させた形態で基板から浮かせた状態で配置・固定する。次いで、核内環境変化を模してクロマチンファイバー周囲の溶液組成を変化させることで、クロマチンファイバーの高次構造変化をおこし、その変化の様子を実時間観察することにより、クロマチンファイバー高次構造の階層性とその動態を明らかにすることを目指す。本研究課題遂行を通して顕微鏡下におけるシングルセル・単分子レベル生化学実験手法を確立し、動的クロマチン構造と機能の解明に貢献する。
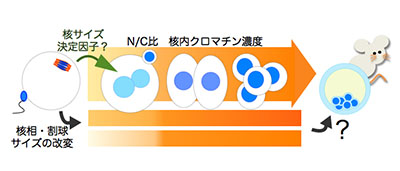
 「マウス卵割期胚におけるNC比制御と核形態・クロマチン状態変化の解析」
「マウス卵割期胚におけるNC比制御と核形態・クロマチン状態変化の解析」代表者:大杉 美穂
細胞における核と細胞質の体積比(N/C比)は、分化度や腫瘍の悪性度など、細胞の状態を反映する指標の1つとして古くから知られている。哺乳動物の着床前胚発生においても、割球に含まれる核の形状が細胞の分化や胚の発生を運命付ける要因の1つとなっているが、核の大きさや形態の決定機構に関しての知見はまだ少ない。本研究では細胞(割球)の大きさ、核の形態および内包されるクロマチンの量(密度)に着目し、発生工学、細胞生物学的手法に加え独自の新規手法であるマウス卵抽出液無細胞系による精子からの前核誘導の系を用いて、胚発生に必要な条件を見出すことを目指す。
 「核膜アンカーに依存したセントロメアクロマチン制御機構の解析」
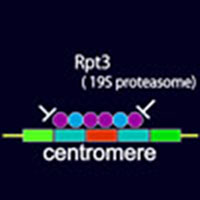
「核膜アンカーに依存したセントロメアクロマチン制御機構の解析」代表者:松本 智裕
セントロメアクロマチンの際立った特徴は、ヒストンH3のバリアントであるCenp-Aを含むことである。セントロメアの大きさや、その領域のヌクレオソームの密度、Cenp-AヌクレオソームとH3ヌクレオソームとの比率は、厳密な制御を受けており、その破綻は、染色体の均等分配や転写制御等に異常を来す。我々が単離した変異体(rpt3-1)では、Cenp-A がより広範囲に、高密度にセントロメア領域に取り込まれ、セントロメア領域のサイレンシング(転写抑制)が亢進することを見つけた。これからの研究では、Rpt3タンパク質と協調して働く因子を理解するとともに、これらのタンパク質がセントロメアにおける余剰のCenp-Aヌクレオソームを察知するメカニズムを解析する。また、Cenp-Aヌクレオソームの拡散を防止する境界配列を同定したので、この配列の機能解明を目指す。
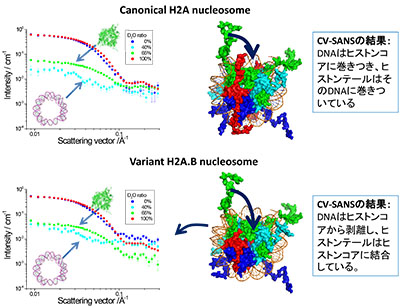
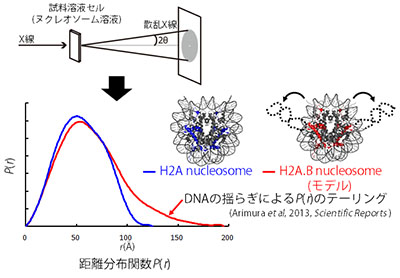
 「CV-SANS法による変異型ヌクレオソームの詳細構造解析」
「CV-SANS法による変異型ヌクレオソームの詳細構造解析」代表者:杉山 正明
コントラスト変調を用いた中性子小角散乱(CV-SANS)法により溶液中でのヌクレオソームの詳細な構造解析を行う。CV-SANS法の特徴は、溶媒の軽水/重水比率を調整する事で、複合生体高分子中の特定部位の構造のみを付加的なラベリングなしで選択的に観測可能な点である。ヒストンとDNAの複合体であるヌクレオソームでは、40%重水中でDNA、65%重水中ではヒストンのみが観測される。この手法を用いて、H2AがH2A.Bに置換されたヌクレオソームのDNAの配位だけでなくヒストンテールの配置も異なっている事を見出している。今後は他のヒストン欠損・ヒストンバリアント置換のヌクレオソームなどのDNA・ヒストンコア・ヒストンテールの構造解析を行い、これらのヌクレオソームの機能発現機構の解明に迫りたい。
 「相同染色体対合に必要な非コードRNAが動的クロマチン構造と相互作用する仕組み」
「相同染色体対合に必要な非コードRNAが動的クロマチン構造と相互作用する仕組み」代表者:平岡 泰
相同染色体の対合・組換えは、正常な減数分裂に必須であり、その理解は生殖を行うすべての真核生物に共通に重要である。分裂酵母では、減数分裂期に特定の遺伝子から転写され、その遺伝子座に蓄積する非コードRNAが、相同染色体の対合に必須であることがわかっている。しかし、このような非コードRNAが相同染色体の対合を促進する仕組みは分かっていない。本研究では、分裂酵母を用いて、減数分裂特異的に転写される非コードRNA(meiRNA)が染色体上の sme2遺伝子座に蓄積する仕組みを研究し、クロマチン動構造と RNAの相互作用を理解することを目指す。ほ乳類X染色体の不活性化においても、X染色体から転写される非コードRNAがX染色体に蓄積することが、不活性化に重要な働きをする。分子遺伝学的解析と分子イメージングが容易な分裂酵母をモデル生物として用いて解析することにより、真核生物に普遍的な仕組みの解明を目指す。

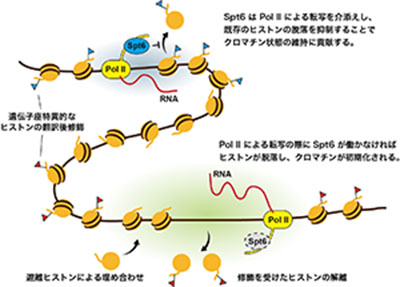
 「転写と共役したクロマチン初期化制御の解析」
「転写と共役したクロマチン初期化制御の解析」代表者:加藤 太陽
真核生物の遺伝子の発現は個々の遺伝子座に刻まれた分子レベルの記憶によって長期的に制御される。代表的なエピジェネティック記憶として「DNAのメチル化」と「ヒストンの翻訳後修飾」を挙げることができる。「DNAのメチル化」が共有結合によって遺伝子座に紐づけられるのに対し、「ヒストンの翻訳後修飾」は、記憶媒体であるヒストンとDNAの非共有結合によって遺伝子座に紐づけられる。この性質は、「記憶の維持」と「記憶の初期化」がヒストンとDNAの結合の強さによって制御できることを暗示する。本研究は、RNAポリメラーゼII(Pol II)による転写の際にヒストンの脱落と交換を抑制することで「記憶の維持」に必須の役割を果たすヒストンシャペロンであるSpt6に着目し、この分子の不活性化による「記憶の初期化」のメカニズムの解明を目指す。
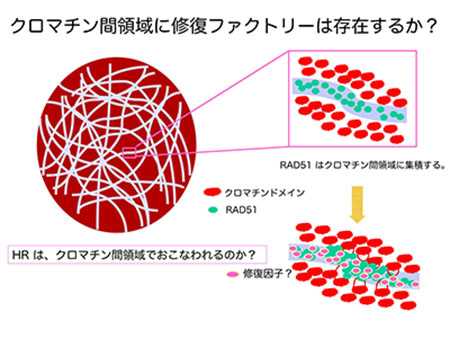
 「ゲノム修復における動的クロマチン構造変換」
「ゲノム修復における動的クロマチン構造変換」代表者:田代 聡
染色体や核内蛋白質が構築する細胞核高次構造はクロマチン構造を反映し、DNA代謝の制御に重要な役割を果たしていると考えられている。染色体領域-クロマチン間領域モデルによれば、染色体領域は数Mbの染色体DNAを含むクロマチンドメインから構築される。転写やスプライシングは、クロマチンドメインの表面で行われる可能性が示されているが、ゲノム修復が細胞核内のどのコンパートメントで行われるのかは不明である。我々は、DNA二本鎖切断の相同組換え修復(HR)で重要な役割を果たすRAD51が、過剰発現によりクロマチン間領域内の束状の領域に集積されること、この領域内にHRのため単鎖化されたDNA が存在することを見いだした。これらの知見から、この束状の領域はHRが行われる場所である可能性が示唆された。そこで本研究では、この束状の領域とHRの関連を検討することで、ゲノム修復における動的クロマチン構造変換の役割の解明に取り組む。
 「長鎖ノンコーディングRNAのクロマチンターゲティング」
「長鎖ノンコーディングRNAのクロマチンターゲティング」代表者:佐渡 敬
エピジェネティック制御因子と相互作用する一部の長鎖ノンコーディング(lncRNA)は、特定のゲノム領域を標的とし、その領域のクロマチン修飾の確立に重要な役割果たす。そうしたlncRNAのクロマチンターゲティング機構は、エピジェネティクスを理解する上で重要な課題の一つといえるが、まだまだ不明な点が多い。哺乳類のメスでは、胚発生初期に2本あるX染色体のうち一方からだけ転写されるXistと呼ばれるlncRNAが、このX染色体全体を覆い、染色体ワイドのヘテロクロマチン化を引き起こす。本研究では、このXist RNAの局在制御に関与することが培養細胞で示されたhnRNP Uに着目し、lncRNAのクロマチンターゲティングにおける機能と役割について解析を行う。

 「新規エピゲノム分析によるクロマチン変異の解析」
「新規エピゲノム分析によるクロマチン変異の解析」代表者:甲斐 雅亮
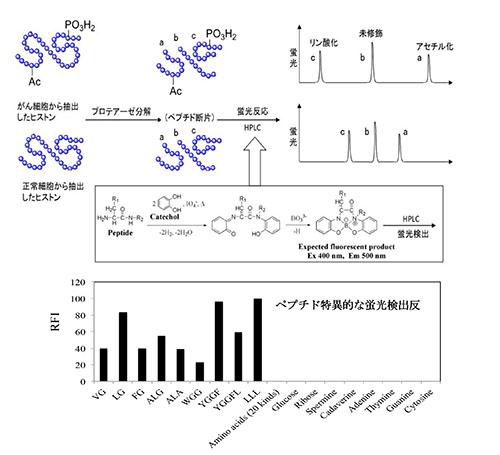
細胞のがん化にはDNAの変異・欠損だけでなく、DNAの暗号情報の変化を伴わないクロマチン変異が深く関与している。本領域ではエピジェネティクスなクロマチン変異の同定を目的とし、以下の研究を行っている。1)核酸塩基(グアニン、ウラシル、シトシン)に対する特異的な蛍光検出反応の開発に成功している。そこで、染色体DNAを各塩基に分解後、がん細胞内遺伝子のメチル化シトシンの簡易な一次スクリーニング法を構築する。2)オリゴペプチドに特異的な蛍光検出反応並びに修飾アミノ酸含有ペプチドのアミノ酸配列蛍光決定法の開発に成功している。そこで、がん細胞由来のヒストンを酵素分解し、蛍光誘導体化したのちHPLCで分離し、蛍光性フラグメントピークの検出パターンを正常細胞のそれらと比較する(図参照)。次に、異常なペプチドフラグメントの修飾アミノ酸配列を決定することによって、がん化におけるヒストン修飾を同定する。
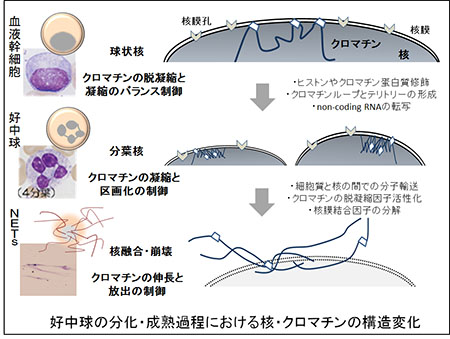
 「血液細胞分化におけるクロマチン動構造の研究」
「血液細胞分化におけるクロマチン動構造の研究」代表者:斉藤 寿仁
好中球は骨髄の血液幹細胞から分化・成熟する白血球の一種である。好中球の核は3~4つに区画化された構造(分葉核)をとることから、他の白血球と簡単に識別できる。好中球は体内で細菌などの病原菌と遭遇すると、それらを捕獲・貪食する。近年、好中球が細菌を貪食後に分葉核内のクロマチンを一斉に伸長させて、細胞外に放出する現象が見いだされた。Neutrophil Extracellular Traps(NETs)と呼ばれるこの特殊な細胞外クロマチン構造は抗菌作用を持つ。このことからNETsの誘導は免疫応答の一つと考えられるが、その生理的な意義や仕組みは十分明らかではない。私たちは当該領域において、好中球の分化・成熟過程で形成される分葉核と、分葉核からNETs構造への変換機序に焦点を当てて研究を進める。イメージングや分子間相互作用の解析から、今まで知られていない核とクロマチン動構造の制御基盤の一端を明らかにできると思っている。
 「ノンコーディングRNA転写と共役したクロマチン構造変化の制御機構の解明」
「ノンコーディングRNA転写と共役したクロマチン構造変化の制御機構の解明」代表者:廣田 耕志
昨今の網羅的転写研究から、ゲノムの大半を占める非コード領域で転写が起こっていることが明らかになった。このような非コードRNA分子転写の意義は議論の的となっている。私たちの研究グループでは、非コードRNA転写にそって、転写領域のクロマチンが開いた構造へと変化する現象を発見し、一般的な非コードRNA転写の意義の一部を解明した。このような、非コードRNA転写と共役したクロマチンの制御は、転写や組換えと言ったDNAに酵素が相互作用する反応に先立ってみられる。非コードRNA転写と共役したクロマチン制御の素過程の理解や、転写因子や抑制因子などによる制御機構との関わりについて解明を行う。

 「X線小角散乱を用いた再構成クロマチンの動的構造解析」
「X線小角散乱を用いた再構成クロマチンの動的構造解析」代表者:小田 隆
クロマチンの構成単位であるヌクレオソームはH2A、H2B、H3、H4からなるヒストン8量体に約150塩基対のDNAが巻き付いた構造体である。ヒストンにはいくつかのバリアントが存在し、それらはクロマチンの動的構造に影響を与えると考えられる。本研究では再構成により調製したヒストンバリアントを含むモノヌクレオソームをX線小角散乱法により解析する。X線小角散乱では、溶液中での揺らいだ状態の構造情報が得られるため、通常のヒストンからなるヌクレオソームとの動的構造の差異を明らかにできる。さらにH1を含むクロマトソームあるいはモノヌクレオソームを数珠つなぎにした再構成クロマチンについても解析を行い、各ヒストンバリアントがクロマチンの動的構造に与える影響を明らかにする。
 「ヌクレオソームの多様な構造を解析する技術の開発」
「ヌクレオソームの多様な構造を解析する技術の開発」代表者:香川 亘
クロマチンはダイナミックに構造変化することによって、生命活動の維持に必要なDNA複製、転写、修復と組換えを可能にする。クロマチン構造変化の分子機構を理解するためには、クロマチンの基本単位であるヌクレオソームにおける構造変化を、原子レベルで明らかにすることが重要である。ヌクレオソームは、それを構成するヒストンとDNA、そして結合因子によって多様な構造を形成することが近年明らかになりつつある。本研究では、多様なヌクレオソーム構造やヌクレオソームとその結合因子との複合体の構造解析を、X線結晶構造解析法を用いて行うための新たな結晶化方法や解析方法の開発を行う。

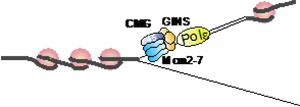
 「DNA複製フォークでのクロマチン構造維持機構」
「DNA複製フォークでのクロマチン構造維持機構」代表者:荒木 弘之
染色体上のクロマチン構造は、DNA複製時に確実に保持される。これは複製因子とクロマチン構造に関わる因子が協調して働き、複製時にクロマチン構造を維持しているためだと考えられているが、その詳細な機構は明らかではない。我々は、出芽酵母を用いてDNA複製の研究を進めてきたが、現在ではin vitro複製系をも用いるに至っている。このin vitro系では、部分的にクロマチン構造をとるDNAの複製が起こる。そこで、この複製系及び精製された複製タンパク質と精製ヒストンからなる疑似複製フォークを用いて、複製時のクロマチン動態の詳細を明らかにする。特に真核生物の活性型DNAヘリカーゼであるCMG複合体とDNAポリメラーゼによるクロマチン構造維持の機構に注目し、複製タンパク質とクロマチン構造に関わる因子がDNA複製時にどのようにクロマチン構造維持に働いているかを解明する。
 「セントロメア・クロマチンの動構造の分子基盤と意義」
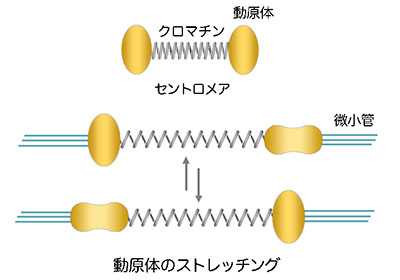
「セントロメア・クロマチンの動構造の分子基盤と意義」代表者:広田 亨
細胞分裂において、染色体動態の制御を担うセントロメアは、高度に凝縮したクロマチンと特異的に局在するタンパク質によって特殊な染色体構造をつくっている。このセントロメアに形成される動原体は、染色体が中期赤道に整列するとき、微小管の重合・脱重合による機械的な力を受けて、ブリージング、オシレーションといった動態を示すことが知られている。我々は、分子イメージング解析によって動原体が伸び縮みすることを見出し、この現象を動原体ストレッチングと呼んだ(図)。本研究では、こうした動的セントロメアの背景にある分子機構と、これらのダイナミズムが生み出す細胞機能を解き進めることによって、セントロメア・クロマチンの動構造にアプローチする。
 「分裂期染色体凝縮におけるコアヒストン・ヌクレオソームの役割」
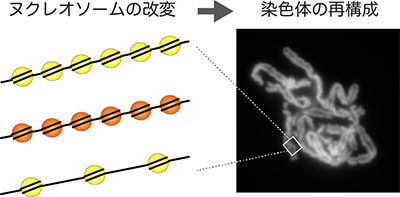
「分裂期染色体凝縮におけるコアヒストン・ヌクレオソームの役割」代表者:新冨 圭史
染色体凝縮は、細胞の一生のうちで最も劇的なクロマチン構造変動であり、遺伝情報の正確な継承に不可欠なイベントである。本研究の目的は、染色体の基本構造ヌクレオソームを構成するコアヒストンが、染色体凝縮にどのようにかかわっているのかを明らかにすることである。そのために、精製タンパク質を用いて染色体を試験管内に再構成する画期的な手法を提案し、コアヒストンをバリアントや変異体に置き換えるなどの実験操作が染色体の形態に与える影響を解析する。また、カエル卵無細胞系を相補的に用いて、ヌクレオソーム密度と凝縮促進因子の機能の関連についても検討する。これらの構成的アプローチから得られる知見は、染色体内でクロマチンがどのように折り畳まれているのかという生物学の古典的命題の解明につながると期待される。
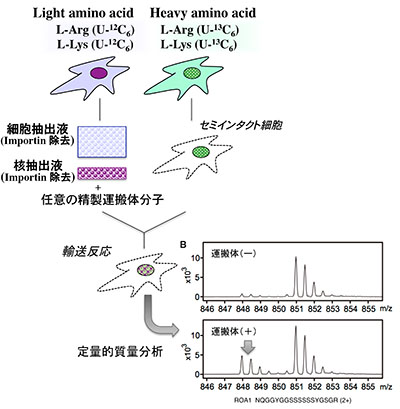
 「核膜孔複合体と輸送運搬体によるImportin輸送制御:細胞核機能から高次生命へ」
「核膜孔複合体と輸送運搬体によるImportin輸送制御:細胞核機能から高次生命へ」代表者:今本 尚子
真核生物では、核と細胞質の間で絶え間ない情報分子の交換が核膜に存在する核膜孔複合体を通して行われている。Importinファミリーと総称される輸送運搬体で担われる輸送経路がヒトには20種類以上存在する。それぞれの輸送経路は異なる基質分子を運搬するため、細胞機能に及ぼす影響が異なると考えられる。また、核膜孔複合体が発生時期や細胞種の違いでその構成が変化することが最近になってわかってきている。核膜孔複合体の構成変化によって個別輸送経路の活性変化も考えられる。本研究では、我々が最近樹立した輸送経路の基質同定系を利用することで、それぞれの輸送経路の機能同定をおこない、核膜孔複合体を含めた輸送システムの活性変化が細胞機能に及ぼす影響を明らかにしていく。核—細胞質間輸送を高次生命の制御システムとして統括的に理解するための基盤を築く。