2010年 9月22日
神経細胞のネットワーク形成には、樹状突起での局所的なタンパク質合成が不可欠(詳細版)
岡崎統合バイオサイエンスセンター・基礎生物学研究所(神経細胞生物学研究室)の椎名伸之准教授、東京工業大学大学院生命理工学研究科の徳永万喜洋教授らの研究グループは、マウスの脳神経細胞を用いて、神経樹状突起での局所的なタンパク質合成が、正常な神経ネットワークの構築に必要であることを明らかにしました。
遺伝子(DNA)はmRNAに転写され、そのmRNAを鋳型にしてタンパク質が合成されます。タンパク質合成は、細胞体(遺伝子が格納されている核の周辺)で行われるのが通常ですが、神経細胞では一部の特定のmRNAが樹状突起へ輸送され、核から遠く離れたその突起内で、細胞体とは独立にタンパク質合成が制御されています。椎名らは、RNA結合タンパク質であるRNG105が、特定のmRNAの樹状突起への輸送に働いていることを明らかにしました。さらに、RNG105遺伝子を破壊してmRNAの輸送ができなくなったマウスの脳神経細胞では、神経突起が発達せず神経ネットワークが退化してしまうことを明らかにしました。
これらのことから、正常に機能する神経ネットワークを構築するためには、樹状突起へのmRNA輸送とそれに伴う局所的タンパク質合成が必要であることがわかりました。以上の成果は、米国神経科学会誌Journal of Neuroscience(ジャーナルオブニューロサイエンス)2010年9月22日号にて発表されます。
[研究の背景]
一つの神経細胞の樹状突起には数千個のスパインと呼ばれる棘があり、そのそれぞれが他の神経細胞の軸索突起の終末に結合し(シナプス結合)、興奮刺激を受け取っています。シナプス結合を介して神経の興奮が伝達されますが、それと同時にその興奮刺激に応答して、樹状突起のスパイン近傍で局所的なタンパク質合成のスイッチがONになります(図1)。局所的タンパク質合成が起こるタイミングは、それぞれのスパインがどの神経細胞から興奮を受け取るかによって異なりますし、細胞体でのタンパク質合成とも異なった制御下にあります。タンパク質合成をONにする決定権が細胞体ではなくそれぞれのスパインに委ねられているという点で、樹状突起における局所的タンパク質合成は「地方分権」的な制御がなされていると言えます。
興奮刺激に応答して局所的に合成されたタンパク質は、シナプス結合を強化したり、シナプスの興奮伝達効率を上げたりする役割を持つと考えられています。そのため、より多くの刺激を受けてより多くのタンパク質を合成したシナプスが、神経ネットワークの主要な繋ぎ目になると考えられています。
樹状突起で局所的タンパク質合成を行うためには、その鋳型となるmRNAをあらかじめそこまで輸送しておく必要があります。その輸送の役割を担うのがRNA粒子と呼ばれる構造体(図1)で、RNA粒子にはRNG105が局在していることを、椎名らはこれまでに見いだしていました。
[本研究の成果]
研究グループは、RNG105が結合するmRNAを同定し、それらmRNAがRNG105によって神経樹状突起へ輸送されることを明らかにしました。RNG105遺伝子破壊によってRNG105を失ったマウスの神経細胞では、それらmRNAの樹状突起への輸送が低下していました。そしてそれに伴って、mRNAを鋳型に合成されるタンパク質の量も樹状突起で低下することがわかりました。
また、RNG105遺伝子破壊マウスでは、神経樹状突起のシナプスが減少しました。さらに、樹状突起は短縮し、神経ネットワークが貧弱に退化してしまうことがわかりました(図2)。その結果、一部の神経細胞は細胞死に至ることもわかりました。RNG105遺伝子破壊マウスは生後呼吸ができずに致死となりますが、その原因は脳幹の神経ネットワークの機能不全にあると考えられています。
RNG105が結合するmRNAを鋳型に合成されるタンパク質の機能は、シナプス伝達の調節、酸化ストレスの防御、細胞死の防御、イオン濃度の恒常性維持など多岐にわたっていました。これらの機能から類推される局所的タンパク質合成の役割は、従来考えられてきたシナプス結合と伝達効率の強化に留まらず、シナプスを介した興奮伝達によって不可避的に引き起こされる環境変化やストレスに対する防御も担っているという新たな可能性が示されました。
[今後の展開]
神経細胞が興奮し、その興奮がシナプスを介して伝達される際には、様々な細胞内ストレスが発生します。そのストレスを抑えつつ、よく使うシナプスと神経回路を強化することが、正しく機能する神経ネットワークを構築する上で重要です。樹状突起における局所的翻訳がそこにどのような役割を果たしているかをさらに明らかにすることが、今後の重要な課題です。
自閉症、統合失調症、アルツハイマー病、パーキンソン病など多くの精神神経疾患の脳では、酸化ストレスをはじめとするストレスの亢進が指摘されています。酸化ストレスにさらされた神経細胞はシナプス結合を失い、他の神経細胞とのネットワークを失って神経変性を起こします。本研究は、それらの疾患治療研究へ向けた新たな枠組みを提示することが期待されます。
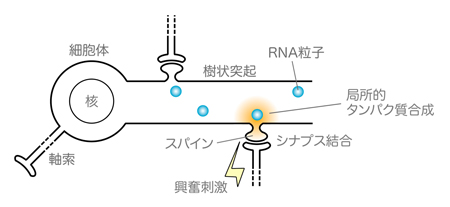
図1:神経樹状突起における局所的タンパク質合成の模式図
RNA粒子に乗って樹状突起へ輸送されたmRNAを鋳型にして、興奮刺激に応じてスパイン付近で局所的なタンパク質合成が起きる。新規に合成されたタンパク質の働きによってシナプスは強化され、そこが神経ネットワークの主要な繋ぎ目となる。
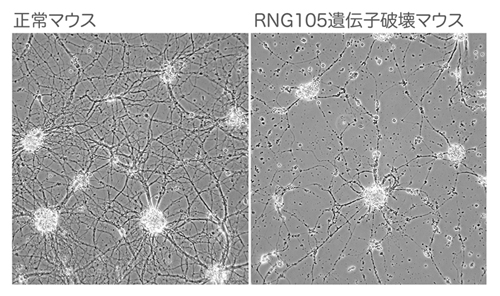
図2:RNG105遺伝子破壊マウスの神経ネットワークは貧弱に退化する
マウスの大脳神経細胞を培養皿上で培養したもの。白っぽい球状のものが細胞体の固まりで、そこから軸索と樹状突起が伸びてネットワークを形成している。RNG105遺伝子破壊マウスの神経細胞では樹状突起への伝令RNA輸送が低下し、この写真のように、神経ネットワークが正常に構築できなくなった。
[発表雑誌]
米国神経科学会誌 Journal of Neuroscience(ジャーナルオブニューロサイエンス)
2010年9月22日号に掲載
論文タイトル:
"RNG105 deficiency impairs the dendritic localization of mRNAs for Na+/K+ ATPase subunit isoforms and leads to the degeneration of neuronal networks"
著者:Nobuyuki Shiina, Kazuhiko Yamaguchi, and Makio Tokunaga
[研究グループ]
本研究は、岡崎統合バイオサイエンスセンター・基礎生物学研究所 神経細胞生物学研究室の椎名伸之准教授、理化学研究所 脳科学総合研究センターの山口和彦博士、東京工業大学大学院生命理工学研究科 生命情報専攻の徳永万喜洋教授により行われました。
[研究サポート]
本研究は、文部科学省科学研究費補助金 特定領域研究「生命現象の1分子イメージング」「分子脳科学」のサポートを受け行われました。また、本研究は独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)の委託業務「細胞内ネットワークのダイナミズム解析技術開発」の成果を活用しています。
[本件に関するお問い合わせ先]
岡崎統合バイオサイエンスセンター・基礎生物学研究所
神経細胞生物学研究室
准教授 椎名 伸之(シイナ ノブユキ)
Tel: 0564-55-7620(研究室)
E-mail: nshiina@nibb.ac.jp
東京工業大学 大学院生命理工学研究科
生命情報専攻
教授 徳永 万喜洋(トクナガ マキオ)
Tel: 045-924-5711(研究室)
E-mail: mtoku@bio.titech.ac.jp
[報道担当]
基礎生物学研究所 広報国際連携室
倉田 智子
Tel: 0564-55-7628
Fax: 0564-55-7597
E-mail: press@nibb.ac.jp
東京工業大学 評価・広報課
上田 英一
Tel: 03-5734-2975
Fax: 03-5734-3661
E-mail: hyo.koh.sya@jim.titech.ac.jp
