トレーニング情報
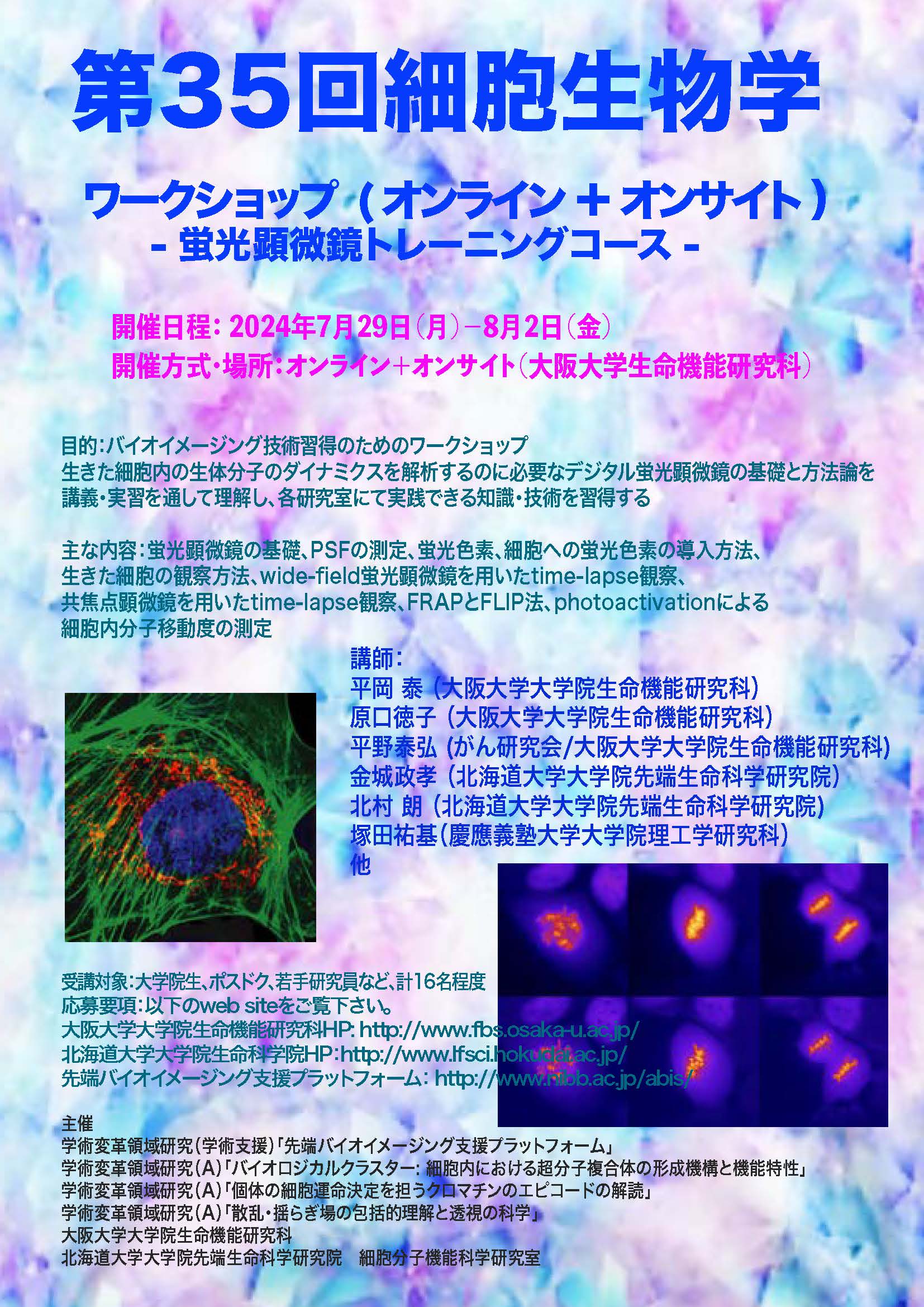
開催概要
ワークショップの目的
生きた細胞内の生体分子のダイナミクスを解析するのに必要なデジタル蛍光顕微鏡の基礎と方法論を講義・実習を通して理解し、各研究室にて実践できるようになる。
ワークショップの主な内容
蛍光顕微鏡の基礎、PSFの測定、蛍光色素、細胞への蛍光色素の導入方法、生きた細胞の観察方法、wide-field蛍光顕微鏡を用いたtime-lapse観察、共焦点顕微鏡を用いたtime-lapse観察、FRAPとFLIP法、photoactivationによる細胞内分子移動度の測定、ImageJを用いた画像解析
ワークショップの達成目標
|
1 |
光学顕微鏡が観察対象を拡大・解像する光学原理を理解し、単レンズを組み合わせて明視野顕微鏡を自作できる。 |
|
2 |
顕微鏡の分解能について理解する。分解能が実空間と周波数空間でどのように定義されるか、および実空間と周波数空間の関連について説明できる。 |
|
3 |
物質(有機色素、蛍光タンパク質)が蛍光を発する分子メカニズムを理解し、蛍光観察に最適な光源、光学フィルター等を選択できる。 |
|
4 |
蛍光顕微鏡で利用されるデジタル検出器(CCD, sCMOS, PMT)の特徴を理解し、目的に合った検出器を選択できる。 |
|
5 |
対物レンズの結像特性(点像分布関数、ザイデル収差、色収差)を理解し、自分の観察対象に合った対物レンズを選択できるようになる。 |
|
6 |
wide-field蛍光顕微鏡・共焦点レーザー蛍光顕微鏡の構成および特徴を理解し、適切に操作できる。 |
|
7 |
細胞への蛍光色素の導入方法と、蛍光色素の導入が細胞または観察対象の分子に与える影響を理解し、適切な蛍光色素の導入を行うことができる。 |
|
8 |
固定細胞観察と生細胞観察で必要とされる観察条件の違いを理解し、細胞が増殖する様子をtime-lapse観察できる。 |
|
9 |
顕微鏡から出力されるデジタル画像がどのように構成されているかを理解する。 |
|
10 |
デジタル画像処理の基礎(輝度定量、プロジェクション、フィルターの適応など)を理解し、科学デジタル画像処理に汎用されているFijiソフトウエアを用いて、簡単な定量操作ができるようになる。 |
|
11 |
共焦点レーザー顕微鏡を用いた光刺激(褪色・活性化)の基礎を理解する。 |
|
12 |
光退色後蛍光回復(FRAP)法を用いて集積構造体におけるタンパク質の結合解離速度を求めることを通じて、蛍光顕微鏡を計測器として利用し、定量的に分子動態を評価できるようになる。 |
受講対象
大学院生、ポスドク、若手研究者など
参加費
無料
受講を検討する際の注意事項
|
・ |
オンサイト受講(人数制限有:10名程度)。オンサイト受講希望者多数の場合は選考を行います。選外となった場合はオンライン受講に切り替えるか否かを選べます。 |
|
・ |
オンライン受講:講義・実習ともZoomによるオンライン配信。 |
|
・ |
講義(午前:9-12時)、実習(14-18時)、総合討論(18-19時)の3部構成です。 |
|
・ |
全期間受講必須とします。途中入退室は原則として認めません。 |
|
・ |
本ワークショップは、どんな蛍光顕微鏡にも共通する「根幹」を理解することを目的としており、特定のメーカーの、特定の顕微鏡の使い方の講習ではありません。 |
|
・ |
本ワークショップは上記「ワークショップの目的」の達成のための必要最低限のことに焦点を絞った内容となっています。特定の顕微手法に興味があるならば、本ワークショップに参加の上、他のワークショップにも参加することを強く推奨します(画像解析、超解像顕微鏡、一分子イメージング、2光子顕微鏡など様々な顕微手法のワークショップが開催されています)。 |
|
・ |
教科書として共立出版「新・生細胞蛍光イメージング」(定価5,500円+税)を使います。ワークショップ特別価格での購入の詳細は、参加者が決定した段階で、各自に連絡します。すでに本を持っている場合は、新たに購入する必要はありません(古い教科書「生細胞蛍光イメージング」を持っている場合は、その本でもかなり対応できます)。 |
主催
学術変革領域研究(学術研究支援基盤形成)「先端バイオイメージング支援プラットフォーム」
学術変革領域研究(A)「バイオロジカルクラスター: 細胞内における超分子複合体の形成機構と機能特性」
学術変革領域研究(A)「個体の細胞運命決定を担うクロマチンのエピコードの解読」
学術変革領域研究(A)「散乱・揺らぎ場の包括的理解と透視の科学」
大阪大学大学院生命機能研究科
北海道大学大学院先端生命科学研究院 細胞分子機能科学研究室
講師
原口徳子(大阪大学大学院生命機能研究科)
平岡泰(大阪大学大学院生命機能研究科)
平野泰弘(がん研究会/大阪大学大学院生命機能研究科)
北村朗(北海道大学大学院先端生命科学研究院)
塚田祐基(慶應義塾大学大学院理工学研究科)
天満健太(大阪大学大学院工学研究科)
浦野泰照(東京大学大学院薬学系研究科)
金城政孝(北海道大学大学院先端生命科学研究院)
堀川一樹(徳島大学先端研究推進センター)
岡田康志(理化学研究所/東京大学大学院理学系研究科)
伊東克秀(浜松ホトニクス)
松田厚志(情報通信研究機構)
木村宏(東京工業大学科学技術創成研究院)
山縣一夫(近畿大学生物理工学研究科)
申込方法
受付期間
2024年6月1日(土)-6月30日(日) (必着)
オンサイトの採択結果は、7月3日(水)にe-mailにて連絡します。
申し込み方法
下記Googleフォームに必要事項を記載。
https://forms.gle/HVgMEcKvDMZQNxsA7
(フォームの入力は6月1日に可能となります)
フォームでは下記の1)から7)を記載して頂きますので、あらかじめ準備の上、ご応募ください。
1)参加希望形式(オンサイトorオンライン)
2)応募者情報:名前(ふりがな)
所属(○○大学大学院○○学研究科、○○学研究室など)
職位(博士後期課程○年、一貫制博士課程○年など)
連絡先(所属の住所、電話番号、FAX番号、E-mail address)
3)指導教官(名前、職名、電話番号、E-mail address:緊急連絡に使用)
4)蛍光顕微鏡の使用経験(顕微鏡機種、経験年数、目的、頻度など)
5)現在の研究対象(例:培養細胞、ショウジョウバエ、酵母など)と、研究内容を簡単にご記入ください。
6)なぜ、このワークショップ受講を希望したか(400字以内)
*オンサイト希望者の選考の際は、この記述を最重要視します。この記述がpoorな方は採択されませんので、しっかり書くようにしてください。
7)このワークショップで修得したい技術
申し込み先・問い合わせ
細胞生物学ワークショップ事務局 担当:平野
〒561-0871 大阪府吹田市山田丘1-3
大阪大学大学院生命機能研究科染色体生物学研究室
E-mail: cbws_office [atmark]fbs.osaka-u.ac.jp([atmark]=@)
スケジュール
講義スケジュール(暫定版)
1日目 (達成目標1-4):蛍光顕微鏡の基礎
|
蛍光顕微鏡の基礎 |
平岡泰 |
大阪大学 |
|
|
フィルターの選び方 |
奥川久 |
クロマテクノロジージャパン |
|
|
(休憩) |
|
|
|
|
3Dイメージング |
平岡泰 |
大阪大学 |
|
|
顕微鏡の光学 |
天満健太 |
大阪大学 |
2日目 (達成目標5,6):対物の結像特性と共焦点
|
蛍光色素の化学的性質 |
浦野泰照 |
東京大学 |
|
|
共焦点顕微鏡の原理 |
平野泰弘 |
大阪大学 |
|
|
(休憩) |
|
|
|
|
共焦点顕微鏡による画像取得 |
平野泰弘 |
大阪大学 |
|
|
顕微鏡カメラの話 |
伊東克秀 |
浜松ホトニクス |
3日目 (達成目標7,8):ライブ観察
|
蛍光タンパク質の話 |
堀川一樹 |
徳島大学 |
|
|
FRETの基礎 |
堀川一樹 |
徳島大学 |
|
|
(休憩) |
|
|
|
|
多点走査型共焦点顕微鏡 |
堀川一樹 |
徳島大学 |
|
|
生細胞イメージング |
原口徳子 |
大阪大学 |
4日目 (達成目標9,10):デジタル画像処理の基礎
|
デジタル画像蛍光 |
塚田祐基 |
慶應大学 |
|
|
デジタル画像処理/denoising |
松田厚志 |
NICT |
|
|
(休憩) |
|
|
|
|
超解像顕微鏡 |
松田厚志 |
NICT |
|
|
Time-lapse顕微鏡 |
平野泰弘 |
がん研/阪大 |
5日目 (達成目標11,12):FRAP
|
FRAPの基礎 |
北村朗 |
北海道大学 |
|
|
FRAPの応用 |
北村朗 |
北海道大学 |
|
|
(休憩) |
|
|
|
|
FCSの基礎 |
金城政孝 |
北海道大学 |
|
|
4次元イメージング |
岡田康志 |
東京大学 |
|
|
非線形カーブフィッティングの |
北村朗 |
北海道大学 |
各講義の主な内容
〇蛍光顕微鏡の基礎
・蛍光顕微鏡の構成
・対物レンズの種類
・各種蛍光フィルター、ダイクロイックミラーの光学特性
・励起光源の種類と特徴
〇蛍光色素の化学的性質
・蛍光とはどのような現象か
・蛍光を発する分子の特徴
・蛍光を発する化学的メカニズム
・蛍光の退色
〇顕微鏡の光学
・レンズを通して観察するとなぜ物体を拡大できるのか
・レンズの結像特性
・分解能とは何か
・光の性質を使った様々な顕微法の特徴
〇顕微鏡カメラの基礎
・カメラはどのようにして画像を記録しているか
・CCDカメラの特徴と構成
・EM-CCDカメラの特徴と構成
・CMOSカメラの特徴と構成
・フォトマルチプライヤーチューブの特徴と構成
〇3Dイメージング
・全視野顕微鏡の構成
・点像分布関数
・全視野顕微鏡の3次元結像特性
・対物レンズの収差とは
・対物レンズの試料に応じた選択
・デコンボリューション法
〇共焦点顕微鏡の原理
・共焦点顕微鏡の構成
・共焦点ピンホール効果
・共焦点顕微鏡の3次元結像特性
・全視野顕微鏡と共焦点顕微鏡の違い
〇共焦点顕微鏡による画像取得
・ピンホールのサイズと位置が画像に与える影響
・スキャンスピード、検出器感度、励起強度などのトレードオフの関係性
〇蛍光タンパク質の特性
・蛍光タンパク質が蛍光を発するメカニズム
・原理から考える蛍光タンパク質多色化のストラテジー
・蛍光タンパク質の利点と応用
〇生細胞イメージング
・生細胞イメージングを成功させるには
・蛍光分子の導入法
・光毒性
〇Time-lapse顕微鏡
・タイムラプス観察に必要とされる顕微鏡の特徴
〇多点走査型共焦点顕微鏡
・多点走査型共焦点顕微鏡の特徴
・光毒性を低減させるためのハード、ソフト両面の工夫
〇デジタル画像
・デジタル画像の成り立ち
・デジタル画像の取り扱い方
・定量とは
〇デジタル画像処理/denoising
・画像処理に用いられるフィルターの特徴
・画像のデノイズ処理
〇FRETの基礎
・FRETとはどのような現象か
・FRETプローブ作成のストラテジー
・FRETの細胞内現象への応用
〇FRAPの基礎
・生細胞内分子ダイナミクスの計測でわかること
・生細胞内分子ダイナミクスの計測に必要なこと
・FRAP法の原理
〇FRAPの応用
・分子ダイナミクスを記述する物理量
-自分の解析のためにどのような物理量が必要かを理解する-
・目的に応じたFRAP解析法の違い
・FLIP法の原理
〇FCSの基礎
・FCSの原理
・FRAPとFCSの比較と使い分け
・FCCSの原理
・FCSの応用
〇4次元イメージング
・どうやったら今より100倍すごい顕微鏡を作ることができるか
・100倍すごい顕微鏡で観察する細胞の世界
実習スケジュール(暫定版)
1日目 (達成目標1,2):顕微鏡の原理と構成
|
10:50-12:50 |
(実習1)単レンズを用いた顕微鏡の組み立てと結像原理 |
|
|
16:00-18:00 |
受講生の研究紹介 |
2日目(達成目標3-6):顕微鏡の結像特性と3Dイメージング
|
14:00-16:00 |
(実習2)3D imaging (wide-field) |
|
|
16:00-18:00 |
(実習3)3D imaging (Confocal) |
3日目(達成目標7,8):ライブ観察
|
14:00-15:00 |
(実習4-1)生細胞イメージング(wide-field) |
|
|
15:00-16:30 |
(実習4-2)生細胞イメージング(confocal) |
|
|
16:30-18:00 |
(実習4-3)生細胞イメージング(Spinning disk confocal) |
4日目(達成目標9,10):デジタル画像処理の基礎
|
14:00-18:00 |
(実習5)デジタル画像処理 |
5日目(達成目標11,12):FRAP
|
14:00-16:00 |
(実習6)FRAP・FLIP |
|
|
16:00-16:30 |
講義:非線形カーブフィッティングの基礎とFRAP等への応用 |
16:30-18:00 |
(実習7)FRAP解析 |
*適宜休憩をはさみます。
最新トレーニングニュース
お問い合わせ・ご相談はこちらまで
どの支援を受けたらよいかわからない。ABiSの支援対象になるかどうか申請前に確認したい。などはもちろんのこと、具体的な技術に関する質問など、バイオイメージングに関することならどんなことでもご相談ください。
バイオイメージング相談窓口ABiSに寄せられるよくある質問をQ&A形式でまとめました。申請される方はまずこちらをご参考ください。
よくあるご質問