太田 啓介

電子顕微鏡レベルの生体構造の観察支援を行います。通常のTEM、SEM観察に加え、FIB-SEMトモグラフィー・Array-Tomographyによる電子顕微鏡三次元解析法を用いた形態解析、またGFPなどの蛍光タンパク質の局在を電子顕微鏡下で相関するCLEM(光電子相関観察)観察など、機能と微細形態を相関する様々な技術を提供します。試料作製や観察対象、まだどの様なアウトプットを求めるのかにより様々な手法から選択していくことが必要となります。電子顕微鏡観察のコンサルティングも含めて支援します。
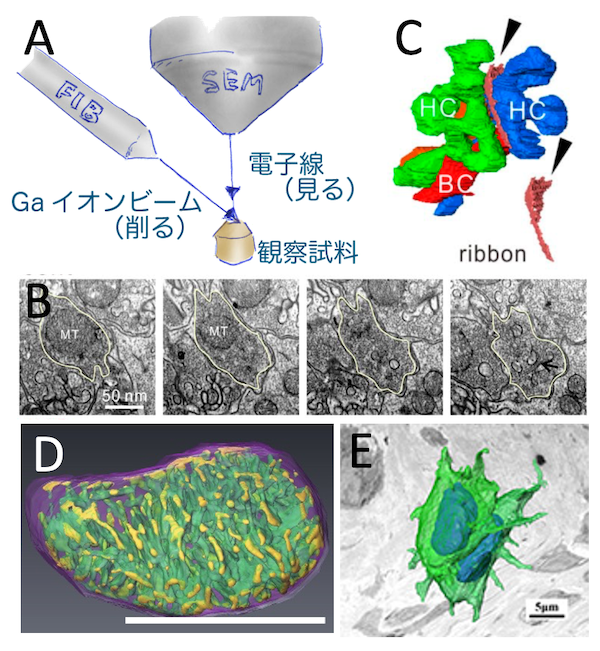
FIB−SEMトモグラフィーによる微細構造三次元観察
収束イオンビーム搭載型走査電子顕微鏡FIB-SEMを用いて組織の微細構造を可視化します(A)。B,Cは網膜のシナプス構造の連続像から3D再構築したもので遺伝子改変による構造変化を観察しました(Hagiwara, JCB,2018)。解析範囲と分解能は、ミトコンドリアのクリステ構造(Ohta, JSB, 2012)から細胞同士の接触レベル(Kanazawa, J Orthop Res 2015)まで調節できますが、三次元再構築の空間分解能は20nm程度で20um各の領域を一つの目安に計画します。分解能と観察領域の大きさはトレードオフなため、何を観察したいのかにより、事前に綿密な打ち合わせが必要です。試料作製段階からご相談ください。
アレイトモグラフィーによる微細構造三次元観察
Array Tomographyは、連続切片をシリコン基板上に回収し、高分解能SEMで連続撮影し再構築するものです。FIB−SEMトモグラフィーと異なり、再観察が出来ること、またTEM用の樹脂包埋ブロックが使えるなどの利点があります。したがって、低倍で観察したあとに高倍率で詳細を捉えることができます。深さ方向の分解能は切片の厚さに依存します。観察領域の目安は、水平方向に数百um各の切片を100~200枚程度作製し観察します。切片の厚さは50~60nm程度を目安に実施しますので 厚さ方向には5~10um程度となり、細胞一つ分を観察できる量になります。

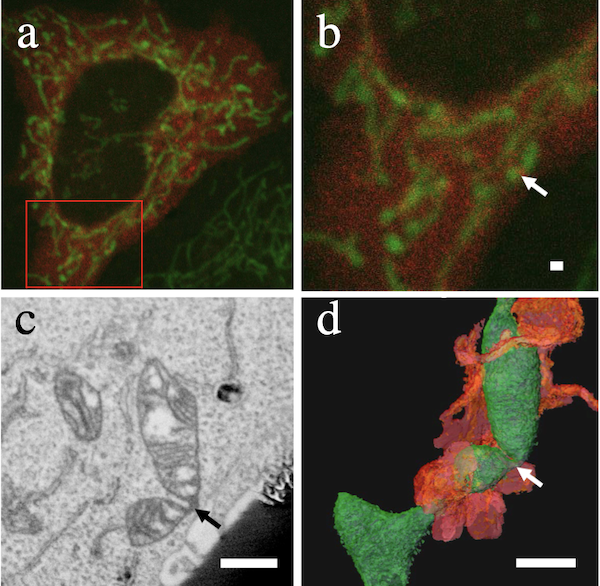
培養細胞におけるVolume CLEM
蛍光顕微鏡で観察したその場を電子顕微鏡で観察するCLEM(Correlative light electron microscopy)は、特定の時空間で生じる生命現象の構造的背景を電子顕微鏡レベルで明らかにする解析手法です。図はミトコンドリア上にDrp1が収束した領域を解析したもので、ミトコンドリア分裂予定域の構造を三次元的に描出しています。本支援ではFIB-SEMトモグラフィー法を応用したVolume-CLEM技術を用い、蛍光顕微鏡下にライブイメージングされた培養細胞のCLEM観察を支援します。現時点ではルーチンで可能な技術ではないため、試料作成からデータ取得に至る事前の十分な打合せが必要です。
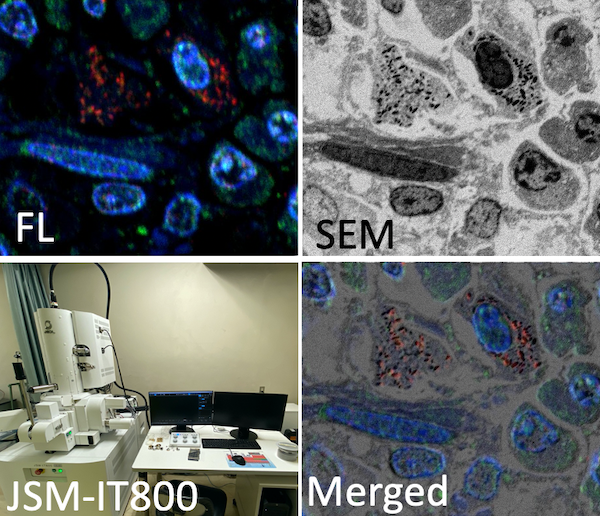
簡易SEM-CLEM
金コロイドを用いた従来の免疫染色に至る前段階として、素早く光顕像と電顕像の相関観察を実現します。切片にした後に蛍光タンパクの発現、もしくは免疫染色によるタンパクの局在を蛍光で観察し、全く同じ試料の同じ場所をSEMで観察することにより、電子顕微鏡下に細胞同定やオルガネラレベルでのタンパク局在を可視化します。
固定後の組織は水溶性樹脂に包埋し、厚さ0.5µmの準超薄切片を作製します。免疫染色を実施しても良いですし、蛍光タンパクを含んでいればそのまま観察される場合が多いです。共焦点レーザー顕微鏡等でその局在を観察後、同領域をSEMで高分解能観察することで、蛍光シグナルと微細形態の相関観察が実現できます。試料作製・切片作製・観察及び相関等の支援をおこないます。
お問い合わせ・ご相談はこちらまで
どの支援を受けたらよいかわからない。ABiSの支援対象になるかどうか申請前に確認したい。などはもちろんのこと、具体的な技術に関する質問など、バイオイメージングに関することならどんなことでもご相談ください。
バイオイメージング相談窓口ABiSに寄せられるよくある質問をQ&A形式でまとめました。申請される方はまずこちらをご参考ください。
よくあるご質問