| |
| 研究内容 |
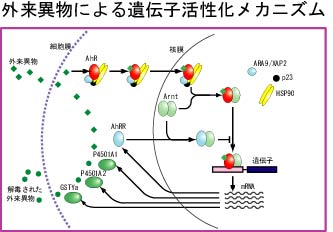
| 私たちの研究グループは外来異物や低酸素ストレスなどの環境ストレスに対する遺伝子応答の分子メカニズムを研究しています。ダイオキシンやPCB、ベンツピレン、メチルコランスレンなどの外来異物によって活性化される遺伝子は、それらをリガンドとして結合する、受容体型転写因子Ahリセプター(AhR)によって活性化されます。細胞質から、核に移行後、Arntとヘテロダイマーを形成し、エンハンサーであるXRE(Xenobiotic
Responsive Element)に結合し転写を活性化します。この過程には図1に示したように、多くのタンパク質が関与しています。低酸素応答に関与する転写因子はHypoxia
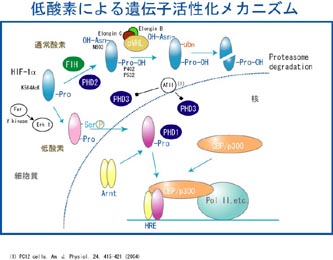
Inducible Factor-1α(HIF-1α)とHLF (HIF-2α)が中心的に働いています。これらの転写因子は、通常酸素濃度下では不安定でユビキチン化され、プロテアソームで分解されます。低酸素では安定化し、核移行した後、Arnt
とヘテロダイマーを形成し、HRE(Hypoxia Response Element)に結合し、転写を活性化します。AhR,
Arnt, HIF-1α, HLFはすべてbHLH-PASドメインをもつ転写因子で、HLHとPASドメインでダイマー形成し、ベーシック配列でDNAに結合します。AhRがArnt
とダイマーを作って、XRE に結合するように、HIF-1αとHLFはArnt とダイマーを作ってHRE に結合します。XREとHREの塩基配列は異なっているので、活性化する遺伝子群は低酸素ストレスと外来異物ストレスでは完全に異なっています。低酸素状態を感知する酸素センサーは長い間不明でしたが、最近HIF-1αとHLFの特別なプロリン残基を、酸素を基質とするプロリン水酸化酵素が見いだされ、酸素センサーと考えられるようになっています。図2に示したように、この水酸化されたプロリンを、がん抑制遺伝子であるVHLがVBC複合体を形成し、E3ユビキチンリガーゼとして、HIF-1αとHLFを認識し、ユビキチン化することが分かっています。この二つの転写活性化メカニズムを中心に、現在はそこで働くタンパク質間相互作用を、FLIM-FRETテクノロジーで可視化することを試みています。 |
| |
 |
| |
 |
 |
十川 和博(研究代表者)
<東北大学・生命科学研究科・教授> |
安元 研一(研究分担者)
<東北大学・生命科学研究科・助教授> |
高崎 親久(研究分担者)
<東北大学・生命科学研究科・助手> |
