Research/研究内容
私たちは、最もシンプルな真核生物の一つである分裂酵母Schizosaccharomyces pombeを用いて、細胞が環境の変化を感知して、
減数分裂を行って配偶子を形成するまでの過程を分子レベルで記載することを目標として研究を行っています。
減数分裂は、精子や卵子などの一倍体の配偶子を形成する上で欠かせない過程で、一度のDNA合成の後、二度の連続した染色体分配が行われます。
この間に、高頻度の遺伝子組換えや、相同染色体が両極に分かれる特殊な染色体分配など、体細胞にはない興味深い現象が見られます。
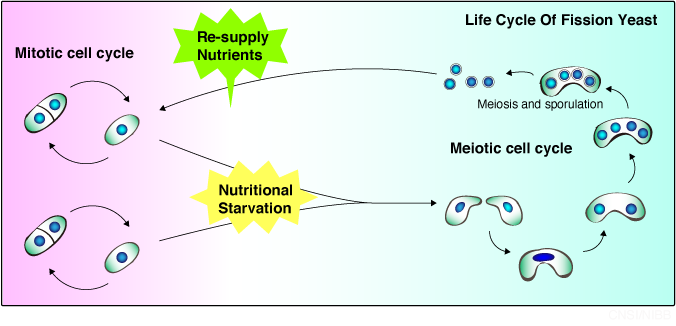
分裂酵母は培地中の栄養の状態に応じて、体細胞分裂で増殖する無性生殖と、減数分裂を経て胞子を形成する有性生殖を使い分けています。
栄養源が豊富な状態では、一倍体で体細胞分裂を行い増殖しますが、培地中の栄養源が枯渇してくると、二つの一倍体細胞が接合して二倍体となって、
引き続いて減数分裂を行い、最終的に配偶子に相当する胞子を形成して、環境の回復を待ちます。単純な生物である分裂酵母の有性生殖過程を研究することで、
種を超えて保存されている、細胞が栄養源を認識する仕組みや、配偶子形成に欠かせない減数分裂の分子機構に迫ることができると期待されます。
TORキナーゼによる栄養源の認識
真核生物で保存されたTORキナーゼ(Target of Rapamycin)は、外界の状況を細胞内に伝えて増殖を制御する経路において中心的な役割を果たしており、
様々な疾患との関わりからも注目を集めています。分裂酵母は、他の生物種と同様に、二つのタイプのTOR複合体を有しています。
興味深いことに、一方のTOR複合体は、有性生殖の開始に対して正に、他方は負に働いています。
私たちは、分裂酵母細胞が、栄養状態をTOR経路を介して伝達し、有性生殖を開始する仕組みの解明に取り組んでいます。
減数分裂期の遺伝子発現制御
細胞は、遺伝子発現を適切に切り替えることで、環境の変化に応答して、様々な機能を獲得しています。
分裂酵母も、栄養源が枯渇して減数分裂期に入ると、数多くの遺伝子の発現を上昇させることが知られています。
減数分裂期の遺伝子発現の上昇に、転写産物の時期特異的な分解制御が大きく寄与していることが私たちの解析によって示されています。
私たちは、減数分裂期の遺伝子発現に欠かせない、RNA分解を制御するRNA結合タンパク質と非コードRNAの機能解明を目指し、研究を行っています。
減数分裂期の細胞骨格制御
分裂酵母の減数分裂の前期には、数時間にわたって核が細胞の両端を往復する特徴的な運動が観察されます。
この核の運動は、その形態からhorsetail運動と呼ばれています。horsetail運動により相同染色体の対合が促進されて、
その結果、正確な染色体分配が行われることになります。horsetail運動は、微小管モータータンパク質である細胞質ダイニンより駆動されています。
私たちは、細胞質ダイニンが特徴的な核運動を誘導するメカニズムを明らかにすることを目指しています。
Research
In our laboratory we use the fission yeast Schizosaccharomyces pombe, the simplest organism that performs meiosis,to research the mechanism by which cells switch from mitosis,
the kind of cell division that divides cells equally to create two identical cells, to meiosis,
which is essential for bringing forth genetically diverse progeny.
Signaling pathways that regulate the onset of sexual differentiation
We have been trying to elucidate how fission yeast cells switch their mode of cell cycle from mitotic to meiotic.
We focus on a highly conserved kinase, namely Target of rapamycin (TOR) kinase,
which plays key roles in the recognition of nutrition and the onset of sexual differentiation in fission yeast.
The molecular mechanisms that establish the meiosis-specific transcription profile
Expression of hundreds of genes is upregulated during meiosis. We have shown that specific control of the stability of meiotic transcripts,
which is orchestrated by the interplay between RNA-binding proteins and a long non-coding RNA,
contributes to the meiosis-specific gene expression in fission yeast.
Understanding precise mechanisms of this control will shed light on the regulation of timely gene expression during meiosis.