|
 |
 |
| |
|
 |
|
|
 |
 |
 |
 |
 |
 |
 |
| 染色体ダイナミクスの生化学・構造生物学的解析 |
 |
| 早稲田大学理工学術院 胡桃坂仁志 平成19−20年度 |
| |
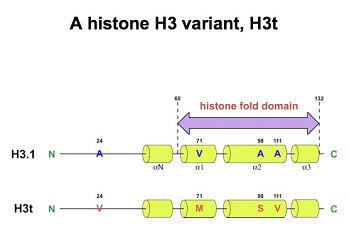
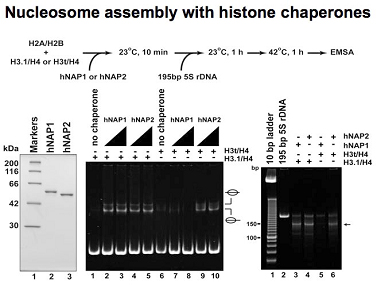
真核生物のゲノムDNAは、ヌクレオソームを基本構成単位とするクロマチンと呼ばれる構造体を形成して核内に収容されている。ヌクレオソームは、ヒストンH2AとH2Bからなるヘテロ二量体と、ヒストンH3とH4からなるヘテロ二量体が、それぞれ二分子ずつ会合してコアヒストン八量体を形成し、その周りに146塩基対のDNAが巻きついた構造を形成している。ヒストンにはバリアントが存在し、特にヒト由来のヒストンH3には、H3.1、H3.2、H3.3、H3t、およびCENP-Aの5種類のバリアントが報告されている。H3.1およびH3.2はS期において複製依存的にクロマチン構造を形成し、一方H3.3は、おもにユークロマチンにおいて、複製非依存的にヌクレオソームを再形成することが報告されている。CENP-Aは、セントロメア特異的なヌクレオソーム形成に重要であり、H3tは精巣での高発現が確認されているバリアントである。これらヒストンバリアントは、生体内でヒストンシャペロンと呼ばれる一群のタンパク質によってヌクレオソームへと取り込まれている。本研究では、ヒストンH3バリアントのヌクレオソーム形成機構を明らかにするために、これらすべてのヒト由来ヒストンH3バリアントをリコンビナントタンパク質として精製し、試験管内でヌクレオソームを再構築する系を確立した。これらのヒストンH3バリアントによるシャペロン依存的なヌクレオソーム形成機構やヌクレオソーム構造変換機構について、新規のヒストンシャペロンであるProtein phosphatase 2Cγ (PP2Cγ)、ヒストンシャペロンNAP-1およびNAP-2を用いて解析を行った。その結果、精巣特異的なH3tバリアントを含むヌクレオソームはNAP-2によって効率良く形成されるが、体細胞で主要なNAP-1では形成されにくいことが明らかになった。
 |
| |
発表論文リスト:
- Hikiba, J., Takizawa, Y., Ikawa, S., Shibata, T., and *Kurumizaka, H. (2009) Biochemical analysis of the human DMC1-I37N polymorphism. FEBS J., 276, 457-465.
- Renodon-Corniere, A. Takizawa, Y., Conilleau1, S., Tran, V., Iwai, S., Kurumizaka, H., and *Takahashi, M. (2008) Structural analysis of the human Rad51 protein-DNA complex filament by tryptophan fluorescence scanning analysis: transmission of allosteric effects between ATP binding and DNA binding. J. Mol. Biol., 383, 575-578.
- Sarai, N., Kagawa, W., Fujikawa, N., Saito, K., Hikiba, J., Tanaka, K., Miyagawa, K., *Kurumizaka, H., and *Yokoayama, S. (2008) Biochemical analysis of the N-terminal domain of human RAD54B. Nucleic Acids Res., 36, 5441-5450.
- Kagawa, W., Kagawa, A., Saito, K., Ikawa, S., Shibata, T., *Kurumizaka, H., and *Yokoyama, S. (2008) Identification of a second DNA binding site in the human Rad52 protein.J. Biol. Chem., 283, 24264-24273.
- Sakane, I., Kamataki, C., Takizawa, Y., Nakashima, M., Toki, S., Ichikawa, H., Ikawa, S., Shibata, T., and *Kurumizaka, H. (2008) Filament formation and robust strand exchange activities of the rice DMC1A and DMC1B proteins. Nucleic Acids Res., 36, 4266-4276.
- Hikiba, J., Hirota, K., Kagawa, W., Ikawa, S., Kinebuchi, T., Sakane, I., Takizawa, Y., Yokoyama, S., Mandon-Pépin, B., Nicolas, A., Shibata, T., *Ohta, K., and *Kurumizaka, H. (2008) Structural and functional analyses of the DMC1-M200V polymorphism found in the human population. Nucleic Acids Res., 36, 4181-4190.
- Nomme, J., Takizawa, Y., Martinez, S., Renodon-Corniére, A., Fleury, F., Weigel, P., Yamamoto, K., Kurumizaka, H., and Takahashi, M. (2008) Inhibition of filament formation of human Rad51 protein by a small peptide derived from the BRC-motif of the BRCA2 protein. Genes Cells, 13, 471-481.
- Tachiwana, H., Osakabe, A., Kimura, H., and *Kurumizaka, H. (2008) Nucleosome formation with the testis-specific histone H3 variant, H3t, by human nucleosome assembly proteins in vitro. Nucleic Acids Res., 36, 2208-2218.
- Ozaki, S., Kawakami, H., Nakamura, K., Fujikawa, N., Kagawa, W., Park, S.Y., Yokoyama, S., Kurumizaka, H., and *Katayama, T. (2008) A common mechanism for the ATP-DnaA-dependent formation of open complexes at the replication origin. J. Biol. Chem., 283, 8351-8362.
- Aoyama, N., Oka, A., Kitayama, K., Kurumizaka, H., and *Harata, M. (2008) The actin-related protein hArp8 accumulate on the mitotic chromosomes and functions in chromosome alignment. Exp. Cell Res., 314, 859-868.
- Morohashi, N., Nakajima, K., Kuwana, S., Tachiwana, H., Kurumizaka, H., and *Shimizu, M. (2008) In vivo and in vitro footprinting of nucleosomes and transcriptional activators using an infrared-fluorescence DNA sequencer. Biol. Pharm. Bull., 31, 187-192.
- Ishida, T., Takizawa, Y., Sakane, I., and *Kurumizaka, H. (2008) The Lys313 residue of the human Rad51 protein negatively regulates the strand-exchange activity. Genes Cells,13, 91-103.
- Keyamura, K., Fujikawa, N., Ishida, T., Ozaki, S., Su’etsugu, M., Fujimitsu, K, Kagawa, W., Yokoyama, S., *Kurumizaka, H., and *Katayama, T. (2007) The interaction of DiaA and DnaA regulates the replication cycle in E. coli by directly promoting ATP-DnaA-specific initiation complexes. Genes & Dev., 21, 2083-2099.
- Ishida, T., Takizawa, Y., Sakane, I., and *Kurumizaka, H. (2007) Altered DNA binding by the human Rad51-R150Q mutant found in breast cancer patients.Biol. Pharm. Bull., 30, 1374-1378.
|
|
 |
 |
 |
 |
 |
 |
 |
| |
|
|
|
|
| |
|
Copyright (c) 2004-2009, nuclear-dynamics. All Rights Reserved. |
|
|
|
|