|
 |
 |
| |
|
 |
|
|
 |
 |
 |
 |
 |
 |
 |
| リンカーヒストンによる細胞未分化性の基盤を成すクロマチンダイナミクス制御 |
 |
| 大阪大学大学院、医学系研究科、遺伝子治療学 青田(浦)聖恵 平成19−20年 |
| |
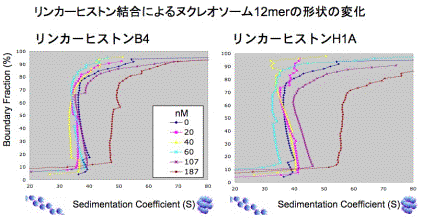
クロマチンを構成するヒストンの種類や翻訳後の修飾状態は様々で、これらヒストン分子の多種多様性が、エピジェネティクスによるゲノム機能調節の根底にある。中でもヒストンH1バリアントは高等真核生物に共通して世代交代や発生・分化にともなって変化する(Godde and Ura, in press)。リンカーヒストンH1はヌムレオソームコアの外側からクロマチンに結合して、クロマチン高次構造を安定化するが、バリアントによるクロマチン構造と機能の違いはよくわかっていない。申請者は、卵細胞特異的なリンカーヒストンH1(B4)がリプログラミングのエピジェネティクス制御の一端を担っていると考え、体細胞型ヒストンH1との違いを明らかにするために、(1)再構成クロマチンと、(2)出芽酵母核、での解析を本研究班で推進した。(1)に関しては、これまでに用いてきたリンカーDNAを含む最小クロマチン単位を再構成するジヌクレオソーム(5S-Dinucleosome)系を改良し、高次のクロマチンファイバー再構成系をリンカーヒストンシャペロンNAP-1を用いて確立した。そして解析型超遠心法による沈降係数測定から、リンカーヒストンB4と体細胞型H1Aを含んだ再構成クロマチンファイバーの形状の違いを見出した。その形状の違いは、ヌクレオソームに対するリンカーヒストンの比によっていずれも大きく変動する。したがって、この系を用いて単純にバリアントの違いで機能を比較することは出来ないとの結論に至った。そして,細胞核で、リンカーヒストンアセンブリーの制御も含めてバリアントによる機能の違いを検証する(2) 出芽酵母核での解析の重要性を確認した。出芽酵母には内在性の通常のリンカーヒストンが存在しない。そこで、出芽酵母にGALプロモーター制御下でC末端にFLAGタグを付加したB4およびH1Aリンカーヒストン遺伝子発現プラスミドを導入した。ガラクトースにより誘導発現したそれぞれのリンカーヒストンは、クロマチンに結合した。すなわち、B4およびH1A、2種のヒストンH1バリアントが結合したクロマチンを出芽酵母核内に構築することに成功した。
 |
| |
発表論文リスト:
- Yuri S., Fujimura S., Nimura K., Takeda., Toyooka, Y., Fujimura Y., Aburatami H., Ura K., Koseki H., Niwa H. and Nishinakamura R. Sall4 is essential for stabilization, but not pluripotency, of embryonic stem cells by repressing aberrant trophectoderm gene expression. Stem Cells,( in press)
- Godde, J.S. and *UraK. Linker Histones and Development. I.J. Dev. Biol., in press.Godde, J.S. and *UraK. Cracking the enigmatic linker histone code. J. Biochem. , 143, 287-293 (2008)
|
|
 |
 |
 |
 |
 |
 |
 |
| |
|
|
|
|
| |
|
Copyright (c) 2004-2009, nuclear-dynamics. All Rights Reserved. |
|
|
|
|