|
 |
 |
| |
|
 |
|
|
 |
 |
 |
 |
 |
 |
 |
| 「核内ドメインへ蛋白をシャトルする新規蛋白MORC3とそのファミリー」 |
 |
地方独立行政法人大阪府立病院機構 成人病センター研究所・分子遺伝学部門 井上徳光
平成17−18年度 |
| |
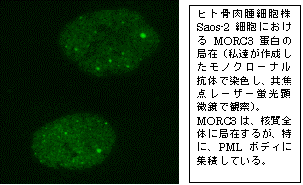
細胞質にゴルジ装置やミトコンドリアなどのオルガネラが存在するように、核内にも、核小体、PMLボディ、Cajalボディなどの様々な核内ドメインが存在する。細胞質オルガネラに局在する蛋白が、正しく局在化するメカニズムは、既に詳しく解析されている一方、核内ドメインへの蛋白局在メカニズムは、よくわかっていない。私達は、GHL-ATPase、CWドメイン、Coiled-coil領域をもつMORCファミリー蛋白 (MORC1,2,3,4)のうちMORC3が、特にPMLボディに集積し、そのATPaseドメイン依存的に、核質とPMLボディをシャトルしている事を明らかにした(論文1)。MORC3は、細胞からATPを除去することにより、PMLボディが形成されているにもかかわらず、核内全体に拡散した。また、ATPase活性に必須の35番目のグルタミン酸をアラニンに変えた変異体もPMLボディに局座することはできなかった。
さらに、PMLボディが、p53の活性化や細胞老化に関わることから、ヒト正常線維芽細胞WI38にMORC3を過剰発現させたところ、WI38は、細胞増殖を止め、細胞老化が誘導された。MORC3過剰発現による細胞老化は、マウス胎児線維芽細胞でも認められたが、癌抑制因子p53ノックアウトマウスの細胞では認められず、p53の活性化によるものと考えられた。
それ故、MORC3は、そのATPase依存的に、PMLボディへ局在化し、p53等の転写因子の活性化を制御している蛋白であると考えられた。
|
| |
表論文リスト:
- Takahashi, K., Yoshida, N., Murakami, N., Kawata, K., Ishizaki, H., Okamoto-Tanaka, M., Miyoshi, J., Zinn, A. R., Shime, H. and Inoue, N. Dynamic Regulation of p53 PML-nuclear body localization and cellular senescence by MORC3. Mol. Biol. Cell. 18, 1701-1709 (2007)
|
|
 |
 |
 |
 |
 |
 |
 |
| |
|
|
|
|
| |
|
Copyright (c) 2004-2009, nuclear-dynamics. All Rights Reserved. |
|
|
|
|