《 基礎生物学研究所要覧 》発生生物学研究系
|
| DIVISION OF MORPHOGENESIS |
|
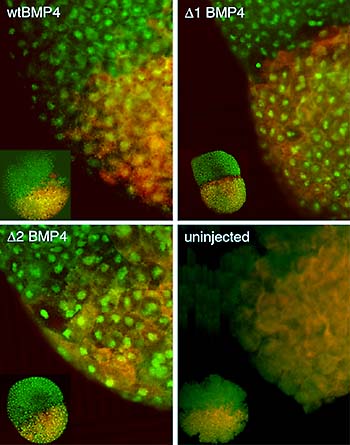
1.細胞増殖因子によるパターン形成のしくみ個体発生の過程では均一な細胞集団が細胞分化によって徐々に異なる性質をもった細胞集団に区画化されていく。この「パターン形成」には細胞間相互作用が必須であり,細胞増殖因子が中心的な役割を担っていることが明らかにされている。これらの細胞増殖因子は産生細胞でつくられたのち,あるものは拡散性が高く「遠距離シグナル」として遠距離にある標的細胞に作用を及ぼすが,あるものは拡散性が低く「近距離シグナル」として近傍の細胞にしか作用しない。同じTGF-βスーパーファミリーに属する細胞増殖因子の中でも,アフリカツメガエルやゼブラフィッシュ初期胚においてアクチビンは遠距離作用を示すのに対し,BMPは近距離作用を示す。我々はこの拡散性の差は一次構造上の特徴にあるものと考え,BMPファミリーに特徴的に見られるN末端側の塩基性アミノ酸配列を欠失した変異BMPの拡散性についてアクチビンと比較した。その結果,変異BMPは生物活性や受容体への親和性は変わらないものの,アクチビン同様に拡散性が著しく高くなっていることを見いだした。さらに,BMPの塩基性アミノ酸はヘパリンとの相互作用に関わっているという結果を得ており,塩基性アミノ酸とヘパラン硫酸プロテオグリカンの相互作用がBMPの拡散を負に制御していることが明らかになった。また,我々は細胞増殖因子の作用を調節するプロテオグリカンの探索から,アフリカツメガエル初期胚の背側に発現するグリピカンXgly4を同定し,その機能解析からXgly4は細胞増殖因子WntファミリーのWnt5aおよびWnt11と物理的に相互作用することを明らかにした。Xgly4はそれらWnt因子のシグナル受容体であるFrizzled (Fz)にリガンドを提示する共受容体として機能するものと考えられる。
2.原腸形成における細胞運動制御機構Wntシグナルによる原腸形成過程の細胞運動制御には,Dishevelledを介したシグナル経路だけでなく,プロテインキナーぜC (PKC)を介したシグナルも関与しているという結果が報告されている。我々は,Wnt受容体frizzledの細胞内領域に結合するタンパク質として,RACK1(receptor for activated Ckinase)を同定した。これは,活性化されたPKCと結合することによって細胞内局在を決定する因子であると考えられている。この因子の初期発生における機能を調べるため,アンチセンスオリゴヌクレオチドを用いたRACK1の機能低下実験を行ったところ,正常な原腸形成運動が阻害されることがわかった。このとき中胚葉の誘導やパタ-ン形成に異常は認められなかった。また,RACK1の過剰発現によっても同様な表現型が観察された。これらの結果から,適正量のRACK1が存在することが原腸形成期のWnt/PKCシグナルによる細胞運動制御に必須であると考えられた。また,RACK1とPKCは,運動している細胞の先端部分(leading edge)に多く局在していた。このことから,これらは細胞の移動に関わる細胞骨格や細胞接着の動態制御に重要な役割を果たしていることが示唆された。私達は,このシグナル経路のコンポーネントをさらに検索することにより,原腸形成というダイナミックな形態形成運動の制御メカニズムを明らかにしていきたいと考えている。 3.ショウジョウバエDppシグナル世代期間2週間のショウジョウバエは,遺伝学的スクリーニングに適したモデル動物である。我々は脊椎動物BMP2/4の相同分子であるDecapentaplegic (Dpp)のシグナル変異体と遺伝学的に相互作用を示す変異体を,網羅的にスクリーニングしてきた。現在までに9種類のサプレッサー変異体(Suppressor of Constitutively ActivatedDpp Signaling: Scad)を単離した。興味深いことに,我々の単離したScad変異の原因遺伝子の多くは核内タンパク(転写因子またはその共役因子)をコードしていた。これらの分子はBMPシグナルの下流,おそらくはターゲット遺伝子の転写レベルで働き,BMPシグナルに対する組織,細胞の応答特異性の違いに貢献しているものと考えられる。 4.ホヤの脊索形成機構原始的な脊索動物である尾索動物ホヤではBrachyury遺伝子(T-box転写 調節因子)は脊索のみに発現し(図2),脊索形成に必須である。この遺伝子の脊索特異的発現制御領域および下流のターゲット遺伝子群を解析することから,脊索形成の分子機構を明らかにすることを目指している。脊索は脊索動物の幼生または成体の正中背側で神経管の直下を頭尾軸に沿って走る器官で,個体発生学的にみて神経誘導を引き起こす器官として,また系統発生学的にみて脊索動物門に含まれる動物群(脊椎動物+頭索動物+尾索動物)を特徴づける最も顕著な形質として,発生学上非常に重要な器官であるといえる。したがって,脊索細胞分化の分子機構は我々ヒトを含めた脊椎動物の起源と進化を解析する道にもつながると考えられる。
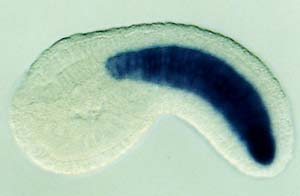
図2. ホヤ幼生の脊索で発現するBrachyuryターゲット遺伝子
5. DNAアレイを用いた遺伝子解析アフリカツメガエルの初期発生過程を,遺伝子発現制御の相互作用の観点からプログラムとして記載すること目指している。マクロアレイやマイクロアレイといった網羅的な遺伝子発現変動の解析手法を用いて,初期胚における背腹軸の形成などに重要な働きを持つ新規な細胞増殖因子のスクリーニング等を試みている。これまでに初期胚より複数のcDNAライブラリーを作成し,そのESTシーケンスを国立遺伝学研究所との共同研究プロジェクトで進め,約70,000を超えるESTシーケンスを収集した。これらのクローンをスポットしたマクロ/マイクロアレイを用いて,時間と空間の2つの要素を考慮した遺伝子発現解析を行っていく。 参考文献
|
| Copyright(C) National Institute for Basic Biology (webmaster@nibb.ac.jp) | ||