《 基礎生物学研究所要覧 》発生生物学研究系
|
| DIVISION OF REPRODUCTIVE BIOLOGY |
|
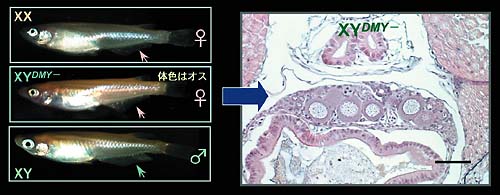
1.メダカの性決定遺伝子性決定遺伝子をポジショナルクローニングにより同定するためには,近交系間の遺伝的差異を利用することができるメダカが最適なモデル生物となる。我々は先ず新潟大学の酒泉、濱口教授らと共同で,コンジェニック系統のメダカを用いてY染色体上にある性決定遺伝子を含む領域を約530 kbまで狭めるとともに,FISH解析により,性決定領域は次中部動原体型染色体の長腕中央部より動原体寄りに位 置することを明らかにした。次いで,ショットガンシーケンス法により,この性決定領域のほぼ全体の塩基配列を明らかにするとともに,Genscanにより52個の遺伝子を予測した。そのうちの一個がショウジョウバエdoublesexと線虫のmab-3に共通 のDMドメインを持つ遺伝子であり,Y染色体特異的であることから,DMYと名づけた。DMYをマーカーとしてメダカ野生集団をスクリーニングすることにより,DMYを持つにもかかわらず表現型が雌である個体を見つけたが,これらのDMY遺伝子には変異がみられた。DMY遺伝子は性分化期のXY個体の生殖腺体細胞に強く発現する。これらの結果 から,DMYはメダカの性決定遺伝子と同定されたが,哺乳類以外の脊椎動物で初めて明らかにされた性決定遺伝子である(図1)。
2.生殖腺の性分化脊椎動物において性決定遺伝子の働きのもとに起こる生殖腺の性分化機構はいまだにほとんど不明である。我々は,メダカ,ティラピア,性転換魚(ハワイ産ベラ,オキナワベニハゼ)などを実験材料に用いて生殖腺の性分化,性転換に関わる遺伝子の同定と機能解析を進めている。ティラピアの遺伝的雌(XX)の生殖腺では,卵巣分化に先行してエストロゲン生成酵素群の発現が認められるが,遺伝的雄(XY)の性分化期生殖腺ではステロイド代謝酵素の発現はみられない。また,孵化直後から内因性エストロゲンの生成(ファドロゾール処理)やエストロゲン受容体の働き(タモキシフェン処理)を抑制すると,遺伝的雌は雄に不可逆的に性転換する。これらの結果から,魚類ではエストロゲンが卵巣の分化に中心的な役割を果たしていると結論される。一方,精巣の分化には性ホルモン(アンドロゲン)ではなく,セルトリ細胞で発現するDMRT1が重要な役割を果たすと考えられる。今後,このDMRT1と性決定遺伝子との関連を解析する必要がある。一方,生殖細胞の起源や分化を解析する実験系として,我々は光る生殖細胞(Vasa-GFP)をもつトランスジェニックメダカ系統を作出することにも成功している。 3.卵の形成と成熟魚類では生殖腺刺激ホルモン (GTH) が濾胞組織に作用することにより,卵(卵黄)形成期にはエストラジオール-17βが,また卵成熟期には卵成熟誘起ホルモンである17α,20β-ジヒドロキシ-4-プレグネン-3-オン(17α,20β-DP)がそれぞれ時期特異的に生成される。サケ科魚類ではエストラジオール-17βも17α,20β-DPも,GTHの作用で濾胞組織を構成する莢膜細胞と顆粒膜細胞の協同作用(2細胞型モデル)で生成される。卵成熟直前の濾胞細胞で起こるエストラジオール-17βから17α,20β-DPへのステロイド合成系の転換には,顆粒膜細胞におけるステロイド代謝酵素遺伝子の発現転換(芳香化酵素→ステロイド-20β-水酸基脱水素酵素)が関わる。また,これら2つの遺伝子の発現は異なる2種の転写制御因子(Ad4BP/SF-1とCREB)により別々に調節されている。 卵成熟期になると,卵成熟誘起ホルモンである17α,20β-DPが充分に成長した卵に作用し卵成熟を誘起する。この時,17α,20β-DPは卵細胞膜上にある新規の膜ステロイド受容体とそれに連絡する抑制性のG蛋白質を介して作用する。17α,20β-DPが卵表に作用すると卵内に新しく卵成熟促進因子(MPF)が形成される。魚類のMPFはcdc2キナーゼとサイクリンBからなる分子量約10万の複合体である。キンギョの未成熟卵にはcdc2キナーゼのみが存在し,サイクリンBは卵に17α,20β-DPが作用して後に新しく合成される。サイクリンB mRNAは未成熟卵中にすでに存在し,17α,20β-DPはその翻訳を開始させる。この過程には翻訳抑制因子の不活性化とサイクリンB mRNAのポリアデニル化が関与する。MPFは受精時に不活性化されるが,この際のサイクリンBの分解に,活性型多機能性プロテアーゼ複合体(26Sプロテアソーム)が中心的役割を果たすことを明らかにした。 4.精子の形成と成熟養殖ウナギの精巣にみられる生殖細胞は精原細胞のみであり,精子形成の制御機構を解析する格好のモデルとなる。本研究部門では,まずこのウナギ精巣の無血清器官培養系を確立し,これにGTHあるいは11-ケトテストステロン(ウナギの精子形成誘起ホルモン,11-KT)を添加することにより,精原細胞に体細胞分裂を起こさせ,さらに減数分裂への移行,精母細胞,精細胞を経て,精子まで分化させることに成功した。これはホルモンにより精子形成の全過程を試験管内で実現させた世界で最初の例である。この実験系を用いてこれらホルモンにより特異的に発現される遺伝子を検索した結果,GTHがライディッヒ細胞に働いて生成される11-KTがセルトリ細胞でのアクチビンβBサブユニット遺伝子の発現を促進させることが判明した。また,ウナギの精巣をCHO細胞でつくらせたウナギのアクチビンBと器官培養すると精原細胞に頻繁な分裂像が観察されることから,アクチビンBは精原細胞の増殖を誘起することにより,精子形成のトリガーを引くものと考えられる。アクチビンBの刺激が精原細胞膜上にあるアクチビンI型およびII型受容体を介して細胞内に伝達される結果,精原細胞でサイクリンE1(G1サイクリン)が新しく生成され,A型精原細胞はS期に移行する。続いてサイクリンA2,B1,B2が生成されて精原細胞の分裂,増殖が起こり,B型精原細胞となる。さらに,減数分裂期に入るとサイクリンA1が新しく生成され,精子形成はさらに進行する。このようにして形成された精子は,さらに生殖腺刺激ホルモンの作用のもとに精巣でつくられる17α,20β-DPの働きにより運動能を獲得し,成熟する。 参考文献
|
| Copyright(C) National Institute for Basic Biology (webmaster@nibb.ac.jp) | ||