|
発芽子葉は陽にあたると緑化し,また木の葉は秋になると紅葉する。こうした植物の営みには,細胞内オルガネラの機能および形態の変動が伴っている。緑化にはエチオプラストからクロロプラストへの,また紅葉にはクロロプラストからクロモプラストへの転換が生じ,葉の色が変わっていく。このようなオルガネラの変換は,植物細胞の成長・分化に伴って頻繁に観察される現象であり,オルガネラ分化の可塑性として捉えられる。このオルガネラ分化の可塑性こそが植物細胞分化の特徴であるその柔軟性を支える基本的性質とみなすことができる。本研究部門では,分子から植物個体まで巾広いレベルから高等植物におけるオルガネラ分化の可塑性を理解することを目指している。
1.ペルオキシソームの機能変換
暗所で発芽させた種子は光照射により緑化し,光合成によって幼植物の生育のエネルギーを得ることになる。この緑化過程には,クロロプラストの発達のみならず,他の構成オルガネラの機能も大きく変動する。一重膜に囲まれたオルガネラであるペルオキシソームでは,糖新生に関与するグリオキシソームが光合成に関与する緑葉ペルオキシソームへと変換する。一方、植物を暗所に置いて,セネッセンス(老化)を起こさせると,全く逆のペルオキシソームの機能転換,つまり緑葉ペルオキシソームからグリオキシソームへの変換が起こることを見いだし,このペルオキシソームの機能変換が可逆的であることを明らかにしている。このペルオキシソーム機能変換の可逆性を支える新規の機能分子を同定する(文献1)とともに、この機能変換がペルオキシソーム酵素の遺伝子発現,mRNAのスプライシング,細胞内輸送,オルガネラ内での分解という各段階で調節されていることが明らかとなってきている。シロイヌナズナ・ペルオキシソーム機能欠損変異株(図1,文献2)やペルオキシソーム形態不全変異株(図2,文献5)を用いたペルオキシソーム機能分化の解析や,ペルオキシソーム形成の鍵となる一群のタンパク質ペルオキシン群の機能解析を進めている。さらに,シロイヌナズナのペルオキシソーム局在タンパク質を2-Dゲルにより分離し、構成成分を網羅的同定することによりペルオキシソーム局在タンパク質の組織別発現マップを作成している。更にゲノム配列から予想されるペルオキシソーム局在タンパク質遺伝子のマイクロアレイを独自に作成し、それを用いて各組織におけるペルオキシソーム局在タンパク質遺伝子発現プロファイルを明らかにしている。これらポストゲノム解析から、ペルオキシソーム機能分化の全容を明らかにしようとしている。
 |
図1. ペルオキシソーム機能欠損二重変異株ped1/ped3の表現型
ped1/ped3 二重突然変異株は、本葉が波打ち、周縁部に不規則な切れ込みが入る(図1 A)。また、花序が形成されにくく、まれに花序が分化しても異常な形態を示し、不稔である(図1B)。これらの表現型は、ped1 突然変異株やped3 突然変異株では見られない。
|
また,植物細胞構築の仕組みを解明するために,プラスチド,ペルオキシソーム等のオルガネラに局在する分子シャペロンに着目し,タンパク質の細胞内輸送,アセンブリー及びオルガネラ分化におけるこれらの分子シャペロンの役割を解析している。その中でクロロプラストには2種のシャペロニン型分子シャペロンが存在し、機能分担していることが判明してきている(文献3)。
2.液胞の機能変換
高等植物の液胞は形態的にも機能的にも大きく変動する能力を備えている。一般的に液胞は,分解型液胞とタンパク質蓄積型液胞の2種類に分けられる。登熟期の種子には,2Sアルブミンなどの貯蔵タンパク質を蓄積するタンパク質蓄積型液胞が存在している。この液胞は,種子の吸水発芽に伴い,分解型液胞へと変化していくことが知られている。これらの液胞の性質を決定する高等植物に特有な機構の解明について研究を進めている。登熟期の種子細胞に存在するタンパク質貯蔵型液胞では,タンパク質輸送に特殊な小胞が関与していることを見出し,PAC(precursor-accumulating)小胞と命名した。最近の研究から、可溶性タンパク質のみならず、膜タンパク質もこの PAC 小胞により液胞へ輸送されることが判明している(文献4)。一方シロイヌナズナに、2Sアルブミンの一部と農薬耐性マーカーを含む融合タンパク質を強制的に発現させることにより、栄養成長細胞内にPAC小胞様の構造体を誘導させることに成功した。現在,PAC小胞様構造体を形成する形質転換シロイヌナズナを用いた遺伝学的解析や,PAC小胞の膜構成タンパク質の網羅的解析により,タンパク質蓄積型液胞と分解型液胞の性質を決定づけている新規なタンパク質輸送系の発見を目指している。
参考文献
- Hayashi, H., DeBellis, L., Ciurli, A., Kondo, M., Hayashi, M. and Nishimura, M. (1999) Anovel oxidase that can oxidize short-chain acyl-CoA in plant peroxisomes. J.Biol. Chem. 274, 12715-12721.
- Hayashi, M., Nito,K., Toriyama-Kato, K., Kondo, M., Yamaya , T. and Nishimura, M. (2000)AtPex14p maintains peroxisomal functions by determining protein targeting tothree kinds of plant peroxisomes. EMBO J. 19, 5701-5710.
- Koumoto, Y.,Shimada T., Kondo M., Hara-Nishimura, I. and Nishimura, M. (2001) Chloroplastshave a novel Cpn10 in addition to Cpn20 as co-chaperonins in Arabidopsis thaliana. J. Biol.Chem. 276, 29688-29694.
- Mitsuhashi, N., Hayashi, Y.,Koumoto, Y., Shimada, T., Fukasawa-Akada, T., Nishimura, M. and Hara-Nishimura,I. (2001) A novel membrane protein that is transported to protein storagevacuoles via precursor-accumulating vesicles. Plant Cell13, 2361-2372.
- Mano, S.,Nakamori, C., Hayashi, M., Kato, A., Kondo, M. and Nishimura, M. (2002)Distribution and characterization of peroxisomes in Arabidopsis byvisualization with GFP: Dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43, 331-341.
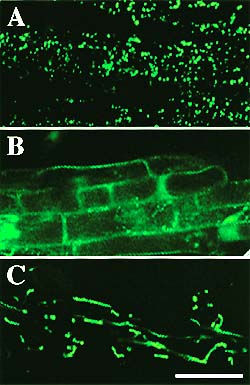 |
図2. ペルオキシソーム形態不全変異株
ペルオキシソーム形成が異常になった変異株の根の細胞を、蛍光顕微鏡で観察した。ペルオキシソームは緑色蛍光タンパク質で可視化されている。(A)正常なペルオキシソームは、約 1μm のドット状の蛍光として観察される。(B) ペルオキシソームへのタンパク質輸送効率が低下し、サイトソルで蛍光が観察される。(C)ペルオキシソームの形が変わり、糸のような長い構造が見られる。バーは 50μm。 |
|

